
ЎҫМвДҝЎҝ№ӨТөЙП»ШКХАыУГДіәПҪр·ПБПЈЁЦчТӘә¬FeЎўCuЎўCoЎўLiөИЈ¬ТСЦӘCoЎўFe¶јКЗЦРөИ»оЖГҪрКфЈ©өД№ӨТХБчіМИзПВЈә
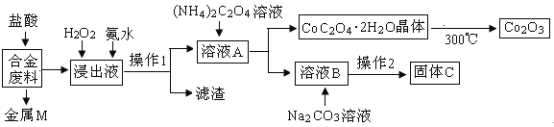
ЈЁ1Ј©ҪрКфMОӘ__________Ј¬ІЩЧч1ОӘ___________ЎЈ
ЈЁ2Ј©јУИлH2O2өДЧчУГКЗЈЁУГАлЧУ·ҪіМКҪұнКҫЈ©________Ј¬јУИл°ұЛ®өДЧчУГКЗ________ЎЈ
ЈЁ3Ј©ід·ЦұәЙХөД»ҜС§·ҪіМКҪОӘ____________ЎЈ
ЈЁ4Ј©ТСЦӘLi2CO3ОўИЬУЪЛ®Ј¬ЖдұҘәНИЬТәөДЕЁ¶ИУлОВ¶И№ШПөјыПВұнЎЈІЩЧч2ЦРЈ¬Хф·ўЕЁЛхәуұШРліГИИ№эВЛЈ¬ЖдФӯТтКЗ___________Ј¬90ЎжКұKspЈЁLi2CO3Ј©өДЦөОӘ___________ЎЈ
ОВ¶И/Ўж | 10 | 30 | 60 | 90 |
ЕЁ¶И/molLЈӯ1 | 0.21 | 0.17 | 0.14 | 0.10 |
ЈЁ5Ј©УГ¶иРФөзј«өзҪвИЫИЪLi2CO3ЦЖИЎп®Ј¬Сфј«ЙъіЙБҪЦЦЖшМеЈ¬ФтСфј«өДөзј«·ҙУҰКҪОӘ__________ЎЈ
Ўҫҙр°ёЎҝCu №эВЛ 2Fe2++H2O2+2H+=2Fe3++2H2O өчҪЪИЬТәөДpHК№Fe3+ЧӘ»ҜОӘFeЈЁOHЈ©3іБөн 4CoC2O42H2O+3O2![]() 2Co2O3+8H2O+8CO2 јхЙЩLi2CO3өДИЬҪвЛрК§ 4.0ЎБ10-3 2CO32--4e-=O2Ўь+CO2Ўь
2Co2O3+8H2O+8CO2 јхЙЩLi2CO3өДИЬҪвЛрК§ 4.0ЎБ10-3 2CO32--4e-=O2Ўь+CO2Ўь
ЎҫҪвОцЎҝ
әПҪр·ПБП(ЦчТӘә¬FeЎўCuЎўCoЎўLiөИЈ¬ТСЦӘCoЎўFe¶јКЗЦРөИ»оЖГҪрКф)јУИлСОЛб№эВЛөГөҪҪрКфMОӘІ»УлСОЛб·ҙУҰөДНӯЈ¬ҪюіцТәЦРјУИл№эСх»ҜЗвСх»ҜСЗМъАлЧУОӘМъАлЧУЈ¬јУИл°ұЛ®өчҪЪИЬТәPHК№МъАлЧУЧӘ»ҜОӘЗвСх»ҜМъіБөнЈ¬НЁ№эІЩЧчўс№эВЛөГөҪИЬТәAЦРјУИлІЭЛбп§ИЬТәіБөноЬАлЧУ№эВЛөГөҪИЬТәBЦчТӘКЗп®АлЧУөДИЬТәЈ¬јУИлМјЛбДЖіБөнп®АлЧУЈ¬№эВЛөГөҪМјЛбп®Ј»Ҫбҫ§ОціцCoC2O42H2OЧгБҝҝХЖшмСЙХөГөҪСх»ҜоЬЈ¬ТФҙЛҪвҙрёГМвЎЈ
әПҪр·ПБП(ЦчТӘә¬FeЎўCuЎўCoЎўLiөИЈ¬ТСЦӘCoЎўFe¶јКЗЦРөИ»оЖГҪрКф)јУИлСОЛб№эВЛөГөҪҪрКфMОӘІ»УлСОЛб·ҙУҰөДНӯЈ¬ҪюіцТәЦРјУИл№эСх»ҜЗвСх»ҜСЗМъАлЧУОӘМъАлЧУЈ¬јУИл°ұЛ®өчҪЪИЬТәPHК№МъАлЧУЧӘ»ҜОӘЗвСх»ҜМъіБөнЈ¬НЁ№эІЩЧчўс№эВЛөГөҪИЬТәAЦРјУИлІЭЛбп§ИЬТәіБөноЬАлЧУ№эВЛөГөҪИЬТәBЦчТӘКЗп®АлЧУөДИЬТәЈ¬јУИлМјЛбДЖіБөнп®АлЧУЈ¬№эВЛөГөҪМјЛбп®Ј»Ҫбҫ§ОціцCoC2O42H2OЧгБҝҝХЖшмСЙХөГөҪСх»ҜоЬЈ»
(1)ЙПКц·ЦОцЕР¶ПҪрКфMОӘCuЈ¬ІЩЧчўсОӘ№эВЛІЩЧчЈ»
(2)јУИлH2O2өДЧчУГКЗСх»ҜСЗМъАлЧУОӘМъАлЧУЈ¬·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә2Fe2++H2O2+2H+=2Fe3++2H2OЈ»јУИл°ұЛ®өДЧчУГКЗөчҪЪИЬТәPHК№Fe3+ЧӘ»ҜОӘFe(OH)3іБөнЈ»
(3)CoC2O4ұәЙХЙъіЙCo2O3ЎўCO2әНЛ®Ј¬·ҙУҰөД»ҜС§·ҪіМКҪОӘ4CoC2O42H2O+3O2![]() 2Co2O3+8H2O+8CO2Ј»
2Co2O3+8H2O+8CO2Ј»
(4)Li2CO3ОўИЬУЪЛ®Ј¬ИЬҪв¶ИЛжОВ¶ИЙэёЯ¶шҪөөНЈ¬ОӘјхЙЩLi2CO3өДИЬҪвЛрК§Ј¬Хф·ўЕЁЛхәуұШРліГИИ№эВЛЈ¬90ЎжКұc(Li2CO3)өДЕЁ¶ИОӘ0.10mol/LЈ¬Фтc(Li+)=0.20mol/LЈ¬c(CO32-)=0.10mol/LЈ¬ФтKsp(Li2CO3)=0.20ЎБ0.20ЎБ0.10=4.0ЎБ10-3Ј»
(5)УГ¶иРФөзј«өзҪвИЫИЪLi2CO3ЦЖИЎп®Ј¬Сфј«ЙъіЙБҪЦЦЖшМеЈ¬УҰОӘ¶юСх»ҜМјәНСхЖшЈ¬өзј«·ҪіМКҪОӘ2CO32--4e-=O2Ўь+CO2ЎьЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»оРФМҝҝЙҙҰАнҙуЖшОЫИҫОпNOЎЈОӘДЈДвёГ№эіМЈ¬TЎжКұЈ¬ФЪ3LГЬұХИЭЖчЦРјУИлNOәН»оРФМҝ·ЫЈ¬·ҙУҰМеПөЦРёчОпЦКөДБҝұд»ҜИзПВұнЛщКҫЎЈПВБРЛө·ЁХэИ·өДКЗ
»оРФМҝ/mol | NO/mol | X/mol | Y/mol | |
ЖрКјКұ | 2.030 | 0.100 | 0 | 0 |
10minҙпЖҪәв | 2.000 | 0.040 | 0.030 | 0.030 |
A. XТ»¶ЁКЗN2Ј¬YТ»¶ЁКЗCO2
B. 10minәуФцҙуС№ЗҝЈ¬NOөДОьКХВКФцҙу
C. 10minәујУИл»оРФМҝЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶Ҝ
D. 0~10minөДЖҪҫщ·ҙУҰЛЩВКv(NO)=0.002 mol/(Lmin)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУЙБҪЦЦФӘЛШЧйіЙөД»ҜәПОпXЈ¬КЗПЦҙъ№ӨТөөДЦШТӘФӯБПЎЈОӘМҪҫҝXөДЧйіЙЈ¬ЙијЖІўҪшРРИзПВКөСйЈә
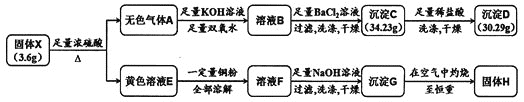
(1)Ҫ«»ЖЙ«ИЬТәEПЎКНәуНЁИлОЮЙ«ЖшМеAЈ¬·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ______________ЎЈ
(2)іэ![]() НвЈ¬ИЬТәFЦРТ»¶Ёә¬УРөДҪрКфСфАлЧУОӘ________Ј¬ЖдјмСй·Ҫ·ЁОӘ______________ЎЈ
НвЈ¬ИЬТәFЦРТ»¶Ёә¬УРөДҪрКфСфАлЧУОӘ________Ј¬ЖдјмСй·Ҫ·ЁОӘ______________ЎЈ
(3)№ММеXУлЕЁБтЛб·ҙУҰөД»ҜС§·ҪіМКҪКЗ_________________ЎЈ
(4)ИфІвөГ№ММеHөДЦКБҝОӘ![]() Ј¬ФтИЬТәEИЬҪвөДНӯ·ЫЦКБҝОӘ________ЎЈ
Ј¬ФтИЬТәEИЬҪвөДНӯ·ЫЦКБҝОӘ________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТФ№иФеНБОӘФШМеөДОеСх»Ҝ¶ю·°ЈЁV2O5Ј©КЗҪУҙҘ·ЁЙъіЙБтЛбөДҙЯ»ҜјБЎЈҙУ·П·°ҙЯ»ҜјБЦР»ШКХV2O5јИұЬГвОЫИҫ»·ҫіУЦУРАыУЪЧКФҙЧЫәПАыУГЎЈ·П·°ҙЯ»ҜјБөДЦчТӘіЙ·ЦОӘЈә
ОпЦК | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
ЦКБҝ·ЦКэ/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | Јј1 |
ТФПВКЗТ»ЦЦ·П·°ҙЯ»ҜјБ»ШКХ№ӨТХВ·ПЯЈә
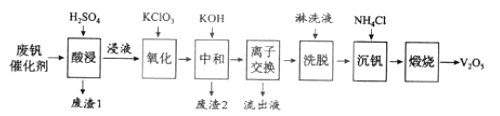
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©Ў°ЛбҪюЎұКұV2O5ЧӘ»ҜОӘVO2+Ј¬·ҙУҰөДАлЧУ·ҪіМКҪОӘ___________Ј¬Н¬КұV2O4ЧӘіЙVO2+ЎЈЎ°·ПФь1ЎұөДЦчТӘіЙ·ЦКЗ__________________ЎЈ
ЈЁ2Ј©Ў°Сх»ҜЎұЦРУыК№3 molөДVO2+ұдОӘVO2+Ј¬ФтРиТӘСх»ҜјБKClO3ЦБЙЩОӘ______molЎЈ
ЈЁ3Ј©Ў°ЦРәНЎұЧчУГЦ®Т»КЗК№·°ТФV4O124РОКҪҙжФЪУЪИЬТәЦРЎЈЎ°·ПФь2ЎұЦРә¬УР_______ЎЈ
ЈЁ4Ј©Ў°АлЧУҪ»»»ЎұәНЎ°ПҙНСЎұҝЙјтөҘұнКҫОӘЈә4ROH+ V4O124![]() R4V4O12+4OHЈЁТФROHОӘЗҝјоРФТхАлЧУҪ»»»КчЦ¬Ј©ЎЈОӘБЛМбёЯПҙНСР§ВКЈ¬БЬПҙТәУҰёГіК_____РФЈЁМоЎ°ЛбЎұЎ°јоЎұЎ°ЦРЎұЈ©ЎЈ
R4V4O12+4OHЈЁТФROHОӘЗҝјоРФТхАлЧУҪ»»»КчЦ¬Ј©ЎЈОӘБЛМбёЯПҙНСР§ВКЈ¬БЬПҙТәУҰёГіК_____РФЈЁМоЎ°ЛбЎұЎ°јоЎұЎ°ЦРЎұЈ©ЎЈ
ЈЁ5Ј©Ў°БчіцТәЎұЦРСфАлЧУЧо¶аөДКЗ________ЎЈ
ЈЁ6Ј©Ў°іБ·°ЎұөГөҪЖ«·°Лбп§ЈЁNH4VO3Ј©іБөнЈ¬РҙіцЎ°мСЙХЎұЦР·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪ____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘ°ұЖшҝЙУлЧЖИИөДСх»ҜНӯ·ҙУҰөГөҪөӘЖшәНҪрКфНӯЈ¬УГПВНјЦРөДЧ°ЦГЈЁКЎВФјРіЦЧ°ЦГј°јУИИЧ°ЦГЈ©ҝЙТФКөПЦёГ·ҙУҰЎЈКөСйКұCЦР·ЫД©ЦрҪҘұдОӘәмЙ«Ј¬DЦРіцПЦОЮЙ«ТәМеЎЈПВБРУР№ШЛө·ЁХэИ·өДКЗ ( )
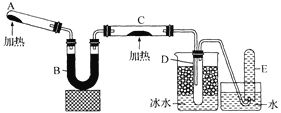
A.КФ№ЬAЦРјУИлөДКФјБОӘNH4Cl№ММе
B.·ҙУҰЦРСх»ҜјБәН»№ФӯјБөДОпЦКөДБҝЦ®ұИОӘ2 : 3
C.Ч°ЦГBЦРјУИлөДОпЦКҝЙТФКЗјоКҜ»Т»тОЮЛ®ВИ»ҜёЖ
D.Ч°ЦГDЦРТәМеҝЙТФК№ёЙФпөДәмЙ«КҜИпКФЦҪұдА¶
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјЛщКҫЧ°ЦГЈ¬өзБчұнЦёХл·ўЙъЖ«ЧӘЈ¬Н¬КұAј«ЦрҪҘұдҙЦЈ¬Bј«ЦрҪҘұдПёЈ¬CОӘөзҪвЦКИЬТәЈ¬ФтAЎўBЎўCУҰКЗПВБРёчЧйЦРөД(ЎЎЎЎ)
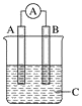
A. AКЗZnЈ¬BКЗCuЈ¬CОӘПЎБтЛб
B. AКЗCuЈ¬BКЗZnЈ¬CОӘПЎБтЛб
C. AКЗFeЈ¬BКЗAgЈ¬CОӘПЎAgNO3ИЬТә
D. AКЗAgЈ¬BКЗFeЈ¬CОӘПЎAgNO3ИЬТә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөӘКЗөШЗтЙПә¬Бҝ·бё»өДТ»ЦЦФӘЛШЈ¬өӘј°Жд»ҜәПОпФЪ№ӨЕ©ТөЙъІъЎўЙъ»оЦРУРЧЕЦШТӘЧчУГЈ¬әПіЙ°ұ№ӨТөФЪ№ъГсЙъІъЦРУРЦШТӘТвТеЎЈТФПВКЗ№ШУЪәПіЙ°ұөДУР№ШОКМвЈ¬Зл»ШҙрЈә
(1)ИфФЪТ»ИЭ»эОӘ2LөДГЬұХИЭЖчЦРјУИл0.2molөДN2әН0.6molөДH2ФЪТ»¶ЁМхјюПВ·ўЙъ·ҙУҰ:N2(g)+3H2(g)![]() 2NH3(g)ҰӨH<0Ј¬ИфФЪ5·ЦЦУКұ·ҙУҰҙпөҪЖҪәвЈ¬ҙЛКұІвөГNH3өДОпЦКөДБҝОӘ0.2molЎЈФтЗ°5·ЦЦУөДЖҪҫщ·ҙУҰЛЩВКv(N2)=__________ЎЈЖҪәвКұH2өДЧӘ»ҜВКОӘ__________%ЎЈ
2NH3(g)ҰӨH<0Ј¬ИфФЪ5·ЦЦУКұ·ҙУҰҙпөҪЖҪәвЈ¬ҙЛКұІвөГNH3өДОпЦКөДБҝОӘ0.2molЎЈФтЗ°5·ЦЦУөДЖҪҫщ·ҙУҰЛЩВКv(N2)=__________ЎЈЖҪәвКұH2өДЧӘ»ҜВКОӘ__________%ЎЈ
(2)ЖҪәвәуЈ¬ИфМбёЯH2өДЧӘ»ҜВКЈ¬ҝЙТФІЙИЎөДҙлК©УР__________ЎЈ
A.јУБЛҙЯ»ҜјБ
B.ФцҙуИЭЖчМе»э
C.ҪөөН·ҙУҰМеПөөДОВ¶И
D.јУИлТ»¶ЁБҝN2
(3)ИфФЪ0.5LөДГЬұХИЭЖчЦРЈ¬Т»¶ЁБҝөДөӘЖшәНЗвЖшҪшРРИзПВ·ҙУҰЈәN2(g)+3H2(g)![]() 2NH3(g)ҰӨH<0Ј¬Жд»ҜС§ЖҪәвіЈКэKУлОВ¶ИTөД№ШПөИзұнЛщКҫЈә
2NH3(g)ҰӨH<0Ј¬Жд»ҜС§ЖҪәвіЈКэKУлОВ¶ИTөД№ШПөИзұнЛщКҫЈә
T/Ўж | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
ЗлНкіЙПВБРОКМвЈә
ўЩКФұИҪПK1ЎўK2өДҙуРЎЈ¬K1__________K2(МоЎ°<ЎұЎ°>Ўұ»тЎ°ЈҪЎұ)Ј»
ўЪ400ЎжКұЈ¬·ҙУҰ2NH3(g)![]() N2(g)+3H2(g)өД»ҜС§ЖҪәвіЈКэОӘ__________ЎЈөұІвөГNH3ЎўN2әНH2ОпЦКөДБҝ·ЦұрОӘ3molЎў2molәН1molКұЈ¬ФтёГ·ҙУҰөДv(N2)Хэ__________v(N2)Дж(МоЎ°<ЎұЎ°>Ўұ»тЎ°ЈҪЎұ)ЎЈ
N2(g)+3H2(g)өД»ҜС§ЖҪәвіЈКэОӘ__________ЎЈөұІвөГNH3ЎўN2әНH2ОпЦКөДБҝ·ЦұрОӘ3molЎў2molәН1molКұЈ¬ФтёГ·ҙУҰөДv(N2)Хэ__________v(N2)Дж(МоЎ°<ЎұЎ°>Ўұ»тЎ°ЈҪЎұ)ЎЈ
(4)ёщҫЭ»ҜС§·ҙУҰЛЩВКәН»ҜС§ЖҪәвАнВЫЈ¬БӘПөәПіЙ°ұөДЙъІъКөјКЈ¬ДгИПОӘПВБРЛө·ЁІ»ХэИ·өДКЗ__________ЎЈ
A.»ҜС§·ҙУҰЛЩВКАнВЫҝЙЦёөјФхСщФЪТ»¶ЁКұјдДЪҝміцІъЖ·
B.АХПДМШБРФӯАнҝЙЦёөјФхСщК№УГУРПЮФӯБП¶аіцІъЖ·
C.ҙЯ»ҜјБөДК№УГКЗМбёЯІъЖ·ІъВКөДУРР§·Ҫ·Ё
D.ХэИ·АыУГ»ҜС§·ҙУҰЛЩВКәН»ҜС§·ҙУҰПЮ¶ИАнВЫ¶јҝЙТФМбёЯ»Ҝ№ӨЙъІъөДЧЫәПҫӯјГР§Тж
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»ҜС§ФЪ»·ҫіұЈ»ӨЦРЖрЧЕК®·ЦЦШТӘөДЧчУГЈ¬өз»ҜС§ҪөҪв![]() өДФӯАнИзНјЛщКҫЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
өДФӯАнИзНјЛщКҫЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
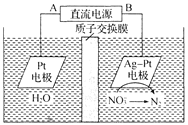
A.AОӘөзФҙөДХэј«
B.ИЬТәЦРHЈ«ҙУСфј«ПтТхј«ЗЁТЖЈ¬Тхј«ЗшөзҪвЦКИЬТәөДpHұЈіЦІ»ұд
C.Ag-Ptөзј«өДөзј«·ҙУҰКҪОӘ![]() Ј«12HЈ«Ј«10eЈӯ=== N2ЎьЈ«6H2O
Ј«12HЈ«Ј«10eЈӯ=== N2ЎьЈ«6H2O
D.өзҪв№эіМЦРЈ¬ГҝЧӘТЖ2 molөзЧУЈ¬ФтЧуІаИЬТәЦКБҝјхЙЩ18 g
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіУР»ъОпҪб№№ОӘ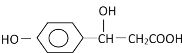 Ј¬ЛьҝЙДЬ·ўЙъөД·ҙУҰАаРНУРЈЁ Ј©
Ј¬ЛьҝЙДЬ·ўЙъөД·ҙУҰАаРНУРЈЁ Ј©
ўЩИЎҙъ ўЪјУіЙ ўЫПыИҘ ўЬЛ®Ҫв ўЭхҘ»Ҝ ўЮЦРәН ўЯСх»Ҝ ўајУҫЫ
A.ўЩўЪўЫўЭўЮB.ўЪўЫўЬўЭўаC.ўЫўЬўЭўЮўЯўаD.ўЩўЪўЫўЭўЮўЯ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com