
【题目】某有机物结构为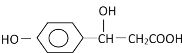 ,它可能发生的反应类型有( )
,它可能发生的反应类型有( )
①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚
A.①②③⑤⑥B.②③④⑤⑧C.③④⑤⑥⑦⑧D.①②③⑤⑥⑦
【答案】D
【解析】
①该物质分子中含有羟基、羧基,可以发生取代反应,①正确;
②该物质含有苯环,在一定条件下能够发生加成反应,②正确;
③由于羟基连接的C原子的邻位C原子上含有H原子,所以在一定条件下能够发生消去反应,③正确;
④该物质无酯基和卤素原子,所以不能发生水解反应,④错误;
⑤该物质含有羟基、羧基,能够发生酯化反应,⑤正确;
⑥该物质含有羧基,能够与碱发生中和反应,⑥正确;
⑦物质含醇羟基,由于羟基连接的C原子上含有H原子,所以可以发生催化氧化反应,也可以发生完全燃烧的氧化反应,⑦正确;
⑧该物质不包含碳碳双键和碳碳三键,所以不能发生加聚反应,⑧错误;
综上所述可知:能够发生的反应为①②③⑤⑥⑦,故合理选项是D。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
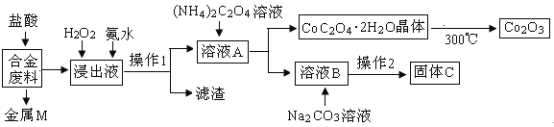
(1)金属M为__________,操作1为___________。
(2)加入H2O2的作用是(用离子方程式表示)________,加入氨水的作用是________。
(3)充分焙烧的化学方程式为____________。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是___________,90℃时Ksp(Li2CO3)的值为___________。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
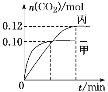
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用向下排气法在容积为VmL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体相对于氢气的密度为9.5,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为
A.![]() VmLB.
VmLB.![]() mLC.
mLC.![]() mLD.无法判断
mLD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为![]() ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
![]() 下列状态的铝中,电离最外层的一个电子所需能量最大的是________
下列状态的铝中,电离最外层的一个电子所需能量最大的是________![]() 填序号
填序号![]() 。
。
①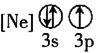 ②
②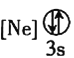 ③
③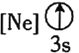 ④
④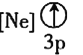
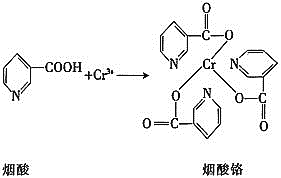
![]() 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
![]() 核外电子排布式为________。
核外电子排布式为________。
![]() 、C、N、O的电负性由大到小的顺序是_________。
、C、N、O的电负性由大到小的顺序是_________。
![]() 烟酸中碳、氮原子的杂化方式分别为________、________。
烟酸中碳、氮原子的杂化方式分别为________、________。
![]() 分子中的大
分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 键可表示为
键可表示为![]() ,则烟酸中的大
,则烟酸中的大![]() 键应表示为___________。
键应表示为___________。
![]() 、
、![]() 都极易水解。
都极易水解。![]() 、
、![]() 都属于______
都属于______![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子,其熔点的关系为
分子,其熔点的关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体![]() 图甲
图甲![]() 可得到稀磁性半导体材料
可得到稀磁性半导体材料![]() 图乙
图乙![]() ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
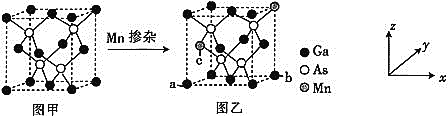
![]() 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,则c点的原子坐标参数为________。
,则c点的原子坐标参数为________。
![]() 设图甲晶体的密度为
设图甲晶体的密度为![]() ,用
,用![]() 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因瓦合金俗称殷钢,是一种镍铁合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
![]() 基态镍原子的价电子轨道表达式为____;铁的基态原子核外未成对电子数为___个。
基态镍原子的价电子轨道表达式为____;铁的基态原子核外未成对电子数为___个。
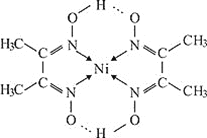
![]() 丁二酮肟
丁二酮肟![]() 分子式为
分子式为![]() 所含的碳、氮、氧三种元素中第一电离能最大的是_____
所含的碳、氮、氧三种元素中第一电离能最大的是_____![]() 填元素符号
填元素符号![]() 。在稀氨水介质中,
。在稀氨水介质中,![]() 与丁二酮肟
与丁二酮肟![]() 分子式为
分子式为![]() 反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为_______;该结构中除含极性键、非极性键、配位键外,还含有__________。
反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为_______;该结构中除含极性键、非极性键、配位键外,还含有__________。
![]() 铁、镍易与CO作用形成羰基配合物
铁、镍易与CO作用形成羰基配合物![]() 、
、![]() 。1个
。1个![]() 分子中含有
分子中含有![]() 键数目为_______;已知
键数目为_______;已知![]() 分子为正四面体构型,下列溶剂能够溶解
分子为正四面体构型,下列溶剂能够溶解![]() 的是_______
的是_______![]() 填写字母
填写字母![]() 。
。
A.四氯化碳 ![]() 苯
苯 ![]() 水
水 ![]() 液氨
液氨
![]() 经查氯化亚铁的熔点为
经查氯化亚铁的熔点为![]() ,沸点为
,沸点为![]() ;而氯化铁的熔点为
;而氯化铁的熔点为![]() ,沸点为
,沸点为![]() 。二者熔沸点差异较大的原因是___________。
。二者熔沸点差异较大的原因是___________。
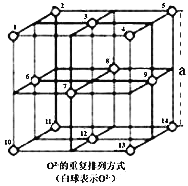
![]() 晶体中,
晶体中,![]() 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的![]() 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的![]() 围成的正八面体空隙;
围成的正八面体空隙;![]() 中有一半的
中有一半的![]() 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半![]() 和
和![]() 填充在正八面体空隙中。则
填充在正八面体空隙中。则![]() 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与![]() 数之比为_______。
数之比为_______。![]() 晶体密度为
晶体密度为![]() ,请计算
,请计算![]() _______
_______![]() 写出计算表达式即可
写出计算表达式即可![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
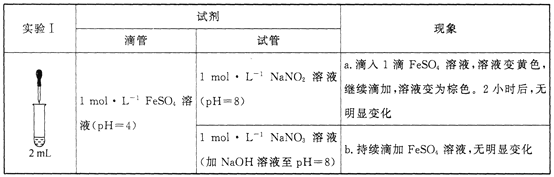
已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。
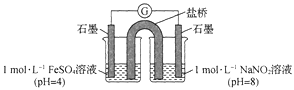
(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单化合物HB在水中达到电离平衡时各种微粒的浓度如下表所示(25 ℃):分析表中①至⑥的数据,下列说法不正确的是( )

A.①与②的数据都说明化合物HB只有部分电离
B.③与④的数据近似相等,说明HB的电离平衡常数与初始浓度无关
C.⑤与⑥的数据说明加水稀释后HB的电离平衡正向移动
D.⑤与⑥的数据说明起始浓度越大,HB电离的程度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、NH4+、S2-、ClO-
B.与Al反应能产生H2的溶液中:Na+、Cu2+、NO3-、I-
C.使甲基橙变红的溶液:Na+、NH4+、SO32-、Cl-
D.![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com