
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
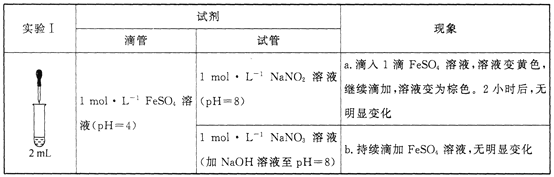
已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。
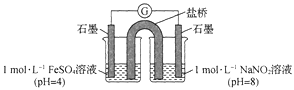
(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
【答案】KSCN 两个实验过程均有O2但NaNO3溶液中无明显变化 ![]() +e-+H2O === NO↑+2OH- 证实Fe2+被
+e-+H2O === NO↑+2OH- 证实Fe2+被![]() 氧化生成Fe3+ 将NO通入FeSO4溶液中溶液由浅绿色变黄色最后变棕色,将NO通入Fe2(SO4)3溶液中,无明显变化 Fe2++
氧化生成Fe3+ 将NO通入FeSO4溶液中溶液由浅绿色变黄色最后变棕色,将NO通入Fe2(SO4)3溶液中,无明显变化 Fe2++![]() +2H+=== Fe3++NO↑+H2O Fe2++NO === [Fe(NO)]2+
+2H+=== Fe3++NO↑+H2O Fe2++NO === [Fe(NO)]2+
【解析】
(1)①可用![]() 检验铁离子;
检验铁离子;
②对比实验中滴加溶液都会携带氧气;
③![]() 在正极上得电子被还原生成
在正极上得电子被还原生成![]() ,可证明
,可证明![]() 与亚铁离子发生氧化还原反应;
与亚铁离子发生氧化还原反应;
(2)要证明![]() 与
与![]() 发生了反应,可将
发生了反应,可将![]() 分别通入
分别通入![]() 溶液中,根据颜色变化判断;
溶液中,根据颜色变化判断;
(3)酸性条件下,![]() 溶液、
溶液、![]() 溶液发生氧化还原反应生成
溶液发生氧化还原反应生成![]() ,亚铁离子与
,亚铁离子与![]() 反应生成
反应生成![]() 。
。
(1)①KSCN与铁离子反应,溶液显血红色,则可用![]() 检验铁离子,
检验铁离子,
故答案为:![]() ;
;
②对比实验中滴加溶液都会携带氧气,但![]() 溶液中无明显变化,则
溶液中无明显变化,则![]() 不是主要原因,
不是主要原因,
故答案为:两个实验过程均有![]() ,但
,但![]() 溶液中无明显变化;
溶液中无明显变化;
③![]() 在正极上得电子被还原生成
在正极上得电子被还原生成![]() ,电极方程式为
,电极方程式为![]() ,实验Ⅱ的目的是证实
,实验Ⅱ的目的是证实![]() 被
被![]() 氧化生成
氧化生成![]() ,
,
故答案为:![]() ;证实
;证实![]() 被
被![]() 氧化生成
氧化生成![]() ;
;
(2)想证明![]() 与
与![]() 发生了反应,可将
发生了反应,可将![]() 分别通入
分别通入![]() 溶液中,可观察到将
溶液中,可观察到将![]() 通入
通入![]() 溶液中,溶液由浅绿色变黄色最后变棕色,将
溶液中,溶液由浅绿色变黄色最后变棕色,将![]() 通入
通入![]() 溶液中,无明显变化,
溶液中,无明显变化,
故答案为:将![]() 通入
通入![]() 溶液中,溶液由浅绿色变黄色最后变棕色,将
溶液中,溶液由浅绿色变黄色最后变棕色,将![]() 通入
通入![]() 溶液中,无明显变化;
溶液中,无明显变化;
(3)酸性条件下,![]() 溶液、
溶液、![]() 溶液发生氧化还原反应生成
溶液发生氧化还原反应生成![]() ,亚铁离子与
,亚铁离子与![]() 反应生成
反应生成![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,同时发生
,同时发生![]() ,
,
故答案为:![]() ;
;![]() 。
。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
(2)平衡后,若提高H2的转化率,可以采取的措施有__________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1__________K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是__________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是
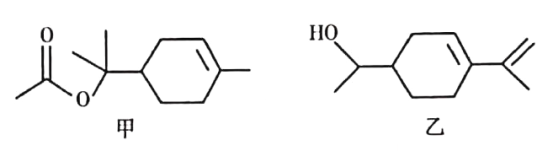
A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构为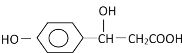 ,它可能发生的反应类型有( )
,它可能发生的反应类型有( )
①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚
A.①②③⑤⑥B.②③④⑤⑧C.③④⑤⑥⑦⑧D.①②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.既有单质参加又有单质生成的反应一定是氧化还原反应
B.发生了颜色变化的一定是化学变化
C.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
D.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某简单微粒的结构示意图为![]() 且X、Y均为不大于20的正整数,据此回答下列问题:
且X、Y均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是_______
(2)若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为________
(3)若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x=_____y=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质Ⅲ(2,3—二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:

下列叙述正确的是
A. 可用溴水可以鉴别化合物Ⅰ和Ⅱ
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
A.C的分解速率是A的生成速率的2倍
B.相同时间内生成n mol A的同时生成3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=9的氨水中:Na+、Al3+、NO3-、Cl-
B.0.1mol·L-1NaOH溶液中:K+、Na+、SO42-、CO32-
C.0.1mol·L-1FeCl3溶液中:K+、NH4+、Cl-、SCN-
D.![]() =1×1012的溶液中:Ca2+、Na+、S2-、MnO4-
=1×1012的溶液中:Ca2+、Na+、S2-、MnO4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com