
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=9的氨水中:Na+、Al3+、NO3-、Cl-
B.0.1mol·L-1NaOH溶液中:K+、Na+、SO42-、CO32-
C.0.1mol·L-1FeCl3溶液中:K+、NH4+、Cl-、SCN-
D.![]() =1×1012的溶液中:Ca2+、Na+、S2-、MnO4-
=1×1012的溶液中:Ca2+、Na+、S2-、MnO4-
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
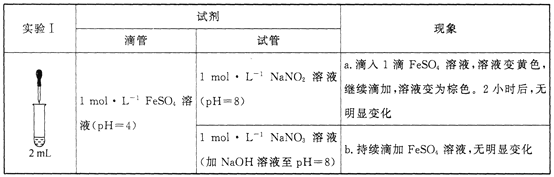
已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。
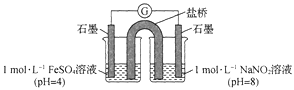
(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C. ![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、NH4+、S2-、ClO-
B.与Al反应能产生H2的溶液中:Na+、Cu2+、NO3-、I-
C.使甲基橙变红的溶液:Na+、NH4+、SO32-、Cl-
D.![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
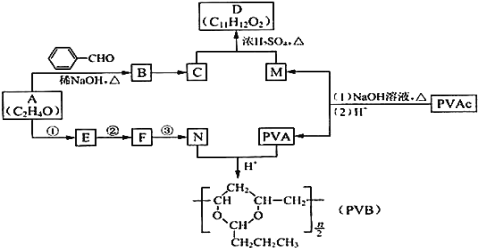
已知:Ⅰ.RCHO+R’CH2CHO![]()
![]() +H2O(R、R’表示烃基或氢)
+H2O(R、R’表示烃基或氢)
Ⅱ.醛与二元醇![]() 如:乙二醇
如:乙二醇![]() 可生成环状缩醛:RCHO+HOCH2CH2OH
可生成环状缩醛:RCHO+HOCH2CH2OH![]()
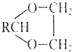 +H2O
+H2O
⑴A的核磁共振氢谱有两种峰.A的名称是 ______
⑵下列关于B的说法正确的是 ______
a.分子式为C9H8O b.所有原子均可在同一平面上
c.最多可以与5molH2发生反应 d.可以使溴水褪色
⑶C为反式结构,由B还原得到。C的结构简式是 ______
⑷G与D含有相同的官能团,相对分子量比D小28,则G的结构有 ______ 种![]() 不包括立体异构
不包括立体异构![]()
⑸E能使Br2的CCl4溶液褪色,N由A经反应①③合成。
a.②的反应类型是 ______
b.③的化学方程式是 ______
⑹PVAc由一种单体经加聚反应得到,该单体的结构简式是 ______
⑺碱性条件下,PVAc完全水解的化学方程式是 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。

①仪器a的名称为___________。
②无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为_____________。
③装置B的主要作用是_____________。
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。

①乙组同学的实验装置中,依次连接的合理顺序为A→B→_____→_____→_____。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞先后加入两种试剂,观察实验现象。分液漏斗中先后加入的试剂是_______________。
③能证明CH3Cl中含有氯元素的实验现象是____________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3Cl中的卤素原子。相关数据如下表:

将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼![]() 是无色、有强还原性的液体,实验室制备水合肼的原理为
是无色、有强还原性的液体,实验室制备水合肼的原理为![]() 据此,某学生设计了下列实验.
据此,某学生设计了下列实验.
(制备NaClO溶液)实验装置如图甲所示![]() 部分夹持装置已省略
部分夹持装置已省略![]()
已知:3NaClO![]()
![]()
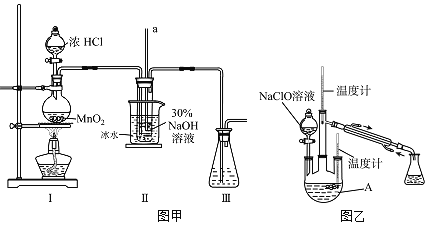
(1)配制![]() 溶液时,所需玻璃仪器除量筒外还有______
溶液时,所需玻璃仪器除量筒外还有______![]() 填字母
填字母![]() 。
。
A.容量瓶![]() 烧杯
烧杯![]() 移液管
移液管![]() 玻璃棒
玻璃棒
(2)装置Ⅰ中发生的离子反应方程式是______;Ⅱ中玻璃管a的作用为______;为了提高NaClO的产率,需对Ⅰ中产生的![]() 进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在
进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在![]() 以下,其主要目的______。
以下,其主要目的______。
(制取水合肼)实验装置如图乙所示
(3)仪器A的名称为______;反应过程中,如果分液漏斗中溶液的滴速过快,部分![]() 参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(测定肼的含量)
(4)称取馏分![]() ,加水配成
,加水配成![]() 溶液,在一定条件下,用
溶液,在一定条件下,用![]() 的
的![]() 溶液滴定.已知:
溶液滴定.已知:![]()
![]() 滴定时,可以选用的指示剂为______;
滴定时,可以选用的指示剂为______;
![]() 实验测得消耗
实验测得消耗![]() 溶液的平均值为
溶液的平均值为![]() ,馏分中
,馏分中![]() 的质量分数为______。
的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是
等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是![]()
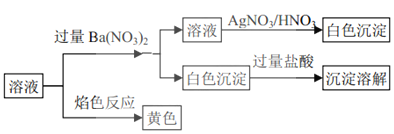
A.该混合物一定是![]() 和NaCl
和NaCl
B.该混合物可能是![]() 和KCl
和KCl
C.该混合物一定是![]() 和NaCl
和NaCl
D.该混合物可能是![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国航天航空事业蒸蒸日上,航天航空的关键技术是火箭,火箭燃料有液氢、乙炔![]() 、甲烷、煤油、肼
、甲烷、煤油、肼![]() 等。请回答下列问题:
等。请回答下列问题:
(1)已知肼的结构简式可表示为![]() 。
。
①肼分子中的化学键类型为 _______________________。
②肼在氧气中燃烧生成无毒的物质,则反应中肼断裂的化学键有N—H键、_______________________,新形成的化学键有_______________________ 。
③根据肼燃烧过程中的能量变化,说明反应物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氢燃料汽车中氢的燃烧与火箭中氢的燃烧最大的不同在于前者使用的是空气作氧化剂,而后者使用的是液氧。火箭中不能使用液化空气,原因是_______________________ 。
(3)火箭发射前,当液氢、液氧加到一定量后,技术人员还要不停地补加,请你说出这种做法的原因_______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com