
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是
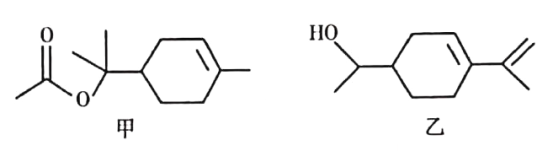
A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷的说法正确的是( )
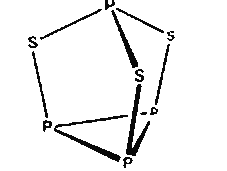
A. 该物质中磷元素的化合价为+3
B. 22 g P4S3含硫原子数目约为1.806×1023
C. 该物质分子结构中S、P最外层电子数均不为8
D. 该物质分子中全是极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业、硫酸工业的生产工艺流程大致为:

合成塔和接触室中的反应分别为:N2(g)+3H2(g)![]() 2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)![]() 2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)写出流程中设备的名称:B____________,X___________。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是_________________。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是____________(填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是_______________________。
(5)工业生产中常用氨——酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
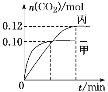
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是
A.等物质的量的12CO2与14CO2含有的中子数
B.同温、同压、同体积的CO2和N2O含有的质子数
C.等质量的己烷和丁烷中含有的共用电子对数
D.等物质的量的钠和铁分别与足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用向下排气法在容积为VmL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体相对于氢气的密度为9.5,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为
A.![]() VmLB.
VmLB.![]() mLC.
mLC.![]() mLD.无法判断
mLD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为![]() ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
![]() 下列状态的铝中,电离最外层的一个电子所需能量最大的是________
下列状态的铝中,电离最外层的一个电子所需能量最大的是________![]() 填序号
填序号![]() 。
。
①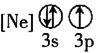 ②
②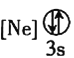 ③
③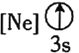 ④
④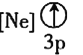
![]() 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
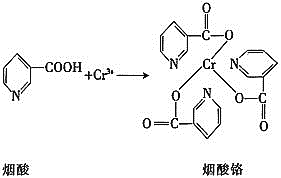
![]() 核外电子排布式为________。
核外电子排布式为________。
![]() 、C、N、O的电负性由大到小的顺序是_________。
、C、N、O的电负性由大到小的顺序是_________。
![]() 烟酸中碳、氮原子的杂化方式分别为________、________。
烟酸中碳、氮原子的杂化方式分别为________、________。
![]() 分子中的大
分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 键可表示为
键可表示为![]() ,则烟酸中的大
,则烟酸中的大![]() 键应表示为___________。
键应表示为___________。
![]() 、
、![]() 都极易水解。
都极易水解。![]() 、
、![]() 都属于______
都属于______![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子,其熔点的关系为
分子,其熔点的关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体![]() 图甲
图甲![]() 可得到稀磁性半导体材料
可得到稀磁性半导体材料![]() 图乙
图乙![]() ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
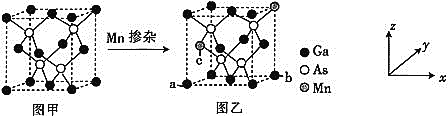
![]() 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,则c点的原子坐标参数为________。
,则c点的原子坐标参数为________。
![]() 设图甲晶体的密度为
设图甲晶体的密度为![]() ,用
,用![]() 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
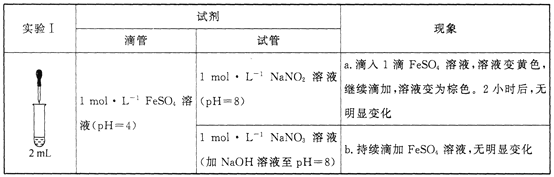
已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。
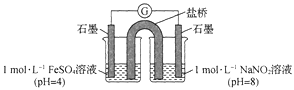
(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C. ![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com