
【题目】因瓦合金俗称殷钢,是一种镍铁合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
![]() 基态镍原子的价电子轨道表达式为____;铁的基态原子核外未成对电子数为___个。
基态镍原子的价电子轨道表达式为____;铁的基态原子核外未成对电子数为___个。
![]() 丁二酮肟
丁二酮肟![]() 分子式为
分子式为![]() 所含的碳、氮、氧三种元素中第一电离能最大的是_____
所含的碳、氮、氧三种元素中第一电离能最大的是_____![]() 填元素符号
填元素符号![]() 。在稀氨水介质中,
。在稀氨水介质中,![]() 与丁二酮肟
与丁二酮肟![]() 分子式为
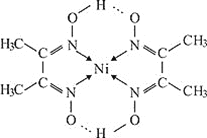
分子式为![]() 反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为_______;该结构中除含极性键、非极性键、配位键外,还含有__________。
反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为_______;该结构中除含极性键、非极性键、配位键外,还含有__________。
![]() 铁、镍易与CO作用形成羰基配合物
铁、镍易与CO作用形成羰基配合物![]() 、
、![]() 。1个
。1个![]() 分子中含有
分子中含有![]() 键数目为_______;已知
键数目为_______;已知![]() 分子为正四面体构型,下列溶剂能够溶解
分子为正四面体构型,下列溶剂能够溶解![]() 的是_______
的是_______![]() 填写字母
填写字母![]() 。
。
A.四氯化碳 ![]() 苯
苯 ![]() 水
水 ![]() 液氨
液氨
![]() 经查氯化亚铁的熔点为
经查氯化亚铁的熔点为![]() ,沸点为
,沸点为![]() ;而氯化铁的熔点为
;而氯化铁的熔点为![]() ,沸点为
,沸点为![]() 。二者熔沸点差异较大的原因是___________。
。二者熔沸点差异较大的原因是___________。
![]() 晶体中,
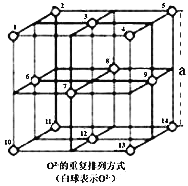
晶体中,![]() 的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的![]() 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的![]() 围成的正八面体空隙;
围成的正八面体空隙;![]() 中有一半的
中有一半的![]() 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半![]() 和
和![]() 填充在正八面体空隙中。则
填充在正八面体空隙中。则![]() 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与![]() 数之比为_______。
数之比为_______。![]() 晶体密度为
晶体密度为![]() ,请计算
,请计算![]() _______
_______![]() 写出计算表达式即可
写出计算表达式即可![]() 。
。
【答案】![]() 4 N
4 N ![]() 、
、![]() 氢键
氢键 ![]() AB 氯化亚铁为离子晶体,而氯化铁为分子晶体
AB 氯化亚铁为离子晶体,而氯化铁为分子晶体 ![]() :1
:1 ![]()
【解析】
(1)基态Ni原子价层电子的排布式为3d84s2,结合泡利原理、洪特规则画出轨道表达式;基态Fe原子核外电子排布式为1s22s22p63s23p63d64s2;
(2)甲基中C原子形成4个σ键、C=N双键中的碳原子形成3个σ键,均没有孤电子对,杂化轨道数目分别为4、3;
(3)Fe与CO形成配位键,CO分子氮气分子互为等电子体,二者结构相似,CO的结构式为C≡O,三键含有2个π键,O原子提供1对电子给C原子,形成1个配位键;Ni(CO)4分子为正四面体构型,属于非极性分子,相似相溶;
(4)镍晶胞为面心立方,顶点Ni原子与面心Ni原子相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共有;由熔点可知,氯化亚铁属于离子晶体,氯化铁属于分子晶体;
(5)由图可知,结构单元中有8个正四面体空隙数,O2-位于图中结构单元的顶点与面心,图中结构单元中O2-数目=8×![]() +6×
+6×![]() =4,根据化合价规则,图中结构单元中有2个Fe3+、1个Fe2+,计算图中结构单元的质量,根据V=
=4,根据化合价规则,图中结构单元中有2个Fe3+、1个Fe2+,计算图中结构单元的质量,根据V=![]() 计算图中结构单元的体积,Fe3O4晶胞中有8个图示结构单元,则晶胞体积为结构单元体积的8倍,8个结构单元形成大的立方体,则该晶胞参数a=
计算图中结构单元的体积,Fe3O4晶胞中有8个图示结构单元,则晶胞体积为结构单元体积的8倍,8个结构单元形成大的立方体,则该晶胞参数a=![]() 。
。
![]() 基态Ni原子价层电子的排布式为
基态Ni原子价层电子的排布式为![]() ,由泡利原理、洪特规则,可得轨道表达式为:
,由泡利原理、洪特规则,可得轨道表达式为:![]() ,基态Fe原子核外电子排布式为
,基态Fe原子核外电子排布式为![]() ,3d轨道有4个电子未成对;
,3d轨道有4个电子未成对;
![]() 因为N的2p轨道是半充满状态较稳定,所以第一电离能最大的元素是N;甲基中C原子形成4个
因为N的2p轨道是半充满状态较稳定,所以第一电离能最大的元素是N;甲基中C原子形成4个![]() 键、
键、![]() 双键中的碳原子形成3个
双键中的碳原子形成3个![]() 键,均没有孤电子对,杂化轨道数目分别为4、3,分别采取
键,均没有孤电子对,杂化轨道数目分别为4、3,分别采取![]() 、
、![]() 杂化;该结构中除含极性键、非极性键、配位键外,还含有氢键;
杂化;该结构中除含极性键、非极性键、配位键外,还含有氢键;
![]() 是中Fe与CO形成5个配位键,CO分子与氮气分子互为等电子体,二者结构相似,CO的结构式为
是中Fe与CO形成5个配位键,CO分子与氮气分子互为等电子体,二者结构相似,CO的结构式为![]() ,其中1个键是O原子提供1对电子给C原子,形成1个配位键,
,其中1个键是O原子提供1对电子给C原子,形成1个配位键,![]() 有5个CO分子,故F
有5个CO分子,故F![]() 分子中有配位键数为
分子中有配位键数为![]() ,
,![]() 分子为正四面体构型,属于非极性分子,相似相溶,能够溶解
分子为正四面体构型,属于非极性分子,相似相溶,能够溶解![]() 的是:四氯化碳、苯,故答案为AB;
的是:四氯化碳、苯,故答案为AB;
![]() 氯化亚铁为离子晶体,熔化时需要破坏离子键,而氯化铁为分子晶体,熔化时需要破坏分子间作用力,二者熔点差别很大;
氯化亚铁为离子晶体,熔化时需要破坏离子键,而氯化铁为分子晶体,熔化时需要破坏分子间作用力,二者熔点差别很大;
![]() 由图可知,结构单元中有8个正四面体空隙数,
由图可知,结构单元中有8个正四面体空隙数,![]() 位于图中结构单元的顶点与面心,图中结构单元中
位于图中结构单元的顶点与面心,图中结构单元中![]() 数目
数目![]() ,
,![]() 晶体中,正四面体空隙数与
晶体中,正四面体空隙数与![]() 数之比为8:
数之比为8:![]() :1;根据化合价规则,图中结构单元中有2个
:1;根据化合价规则,图中结构单元中有2个![]() 、1个
、1个![]() ,图中结构单元的质量
,图中结构单元的质量![]() ,晶体密度为
,晶体密度为![]() ,则图中结构单元的体积
,则图中结构单元的体积![]() ,则该晶胞参数
,则该晶胞参数![]() 。
。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
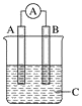
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日中国地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个获得可燃冰连续稳定产气的国家。可燃冰是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。下列说法正确的是( )

①甲烷属于烃类;②相同条件下,甲烷的密度大于空气的密度;③甲烷难溶于水;④可燃冰是一种极具潜力的能源;⑤青藏高原可能存在巨大体积的“可燃冰”
A.①③④⑤B.②③④⑤C.①②③⑤D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构为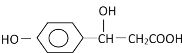 ,它可能发生的反应类型有( )
,它可能发生的反应类型有( )
①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚
A.①②③⑤⑥B.②③④⑤⑧C.③④⑤⑥⑦⑧D.①②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2![]() +CO2+3H2O=2Al(OH)3↓+
+CO2+3H2O=2Al(OH)3↓+![]()
B.用硫酸酸化的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+=2I2+2H2O
C.漂白粉溶液通入少量SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
D.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某简单微粒的结构示意图为![]() 且X、Y均为不大于20的正整数,据此回答下列问题:
且X、Y均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是_______
(2)若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为________
(3)若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x=_____y=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“苏丹红一号”(结构如下图所示)是一种合成染料,科学家通过经毒理学研究,发现长期食用含有苏丹红的食品对人体可能有致癌因素。下列关于“苏丹红一号”的说法中不正确的是

A. 属于芳香族化合物,分子式为C16H12N2O
B. 分子中的所有原子可能位于同一平面上
C. 分子中苯环上的一取代物共有11种
D. 能与NaOH溶液、FeCl3溶液、溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的结构简式为 有甲、乙、丙、丁四个同学将其命名依次为:2,2-二甲基-4-乙基戊烷;3,5,5-三甲基己烷;4,4-二甲基-2-乙基戊烷;2,2,4-三甲基己烷。下列对四位同学的命名判断中正确的是 ( )
有甲、乙、丙、丁四个同学将其命名依次为:2,2-二甲基-4-乙基戊烷;3,5,5-三甲基己烷;4,4-二甲基-2-乙基戊烷;2,2,4-三甲基己烷。下列对四位同学的命名判断中正确的是 ( )
A.甲的命名主链选择是正确的B.乙的命名编号是错误的
C.丙的命名主链选择是正确的D.丁的命名是错误的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com