
【题目】下列各组离子,能在溶液中大量共存的是
A. Na+、Mg2+、Cl-、OH- B. H+、Ca2+、CO32-、NO3-
C. Cu2+、K+、SO42-、NO3- D. Na+、H+、OH-、Ca2+
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H二种元素. 13.6g该有机物经燃烧生成44.0gCO2和14.4gH2O;质谱图表明其相对分子质量为68,红外光谱分析表明A分子中含有位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1.
(1)通过计算确定该有机物A的分子式,并写出A的结构简式
(2)有机物B是A的同分异构体.请写出B的任意两种同分异构体的结构简式、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
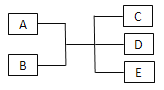
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列说法正确的是

A. 通电后,阳极附近PH增大 B. 电子从负极经电解质溶液回到正极
C. 通电后,A-通过阴离子交换膜从阴极进入浓缩室 D. 当电路中通过2mol电子的电量时,会有11.2LO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是( )
A.提高硫酸铁的溶解度
B.防止硫酸铁分解
C.降低溶液的pH
D.抑制硫酸铁水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
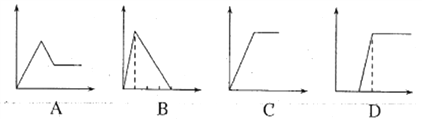
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
Ⅰ、草酸亚铁晶体的制备:

(1)步骤①硫酸亚铁铵晶体加稀硫酸溶解的原因是___________________。
(2)步骤2倾析的作用是使固液分离,具体操作是静置后,将沉淀上部的溶液倾入另一容器,从而获得固体。倾析法与普通的过滤相比,明显的优点是____________________。
(3)硫酸亚铁铵俗称莫尔盐,在空气中比一般的亚铁盐稳定,较难被氧化,其水溶液的性质与组成它的简单盐的混合溶液没有区别。设计简单实验证明硫酸亚铁铵比硫酸亚铁更稳定______________________。
Ⅱ、测定草酸亚铁的纯度:
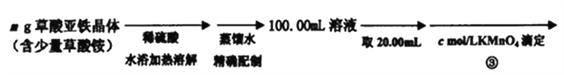
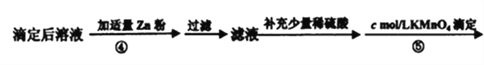
(4)在步骤③的溶液中除发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O 外,还有另一氧化还原反应,写出该反应的离子方程式__________________ ;用KmnO4标准溶液滴定至终点的现象是_____________________。
(5)步骤④加入适量锌粉的目的是________________。
(6)相同条件下,重复滴定三次,步骤③平均消耗KmnO4标准溶液V1mL,步骤⑤平均消耗V2mL,则mg固体样品的纯度计算式为______________。(用相关字母表示,不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,下列说法错误的是( )
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | a |
乙 | c1 | 0.2 | 7 |
丙 | 0.2 | 0.1 | 7 |
丁 | 0.1 | 0.1 | 9 |
A. 若a=7,HA为强酸;若a>7,HA为弱酸
B. 单从乙组情况分析,c1不一定等于0.2molL-1,混合溶液中离子浓度c(A-)=c(Na+)
C. 从丙组实验结果分析,HA是弱酸,混合溶液中离子浓度c(Na+)=c(A-)>c(OH-)=c(H+)
D. 丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5 molL-1,c(OH-)-c(HA)= 1×10-10molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com