
| A����ˮ���������H+��Ũ����1.0��10-12mol?L-1 |
| B�����¶ȸ���25�� |
| C��NaHSO4����ļ���������ˮ�ĵ��� |
| D�����¶��¼�������pHΪ12��NaOH��Һ��ʹ����Һǡ�ó����� |
| 10-12 |
| 0.01 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȡ����������ͨ©������� |
| B��Ũ�ռ�Һմ��Ƥ����Ӧ������ϡ�����ϴ |
| C��������ƿ���ƺ�һ��Ũ�ȵ�ij��Һ����Һ����������ƿ�в����ϱ�ǩ |
| D����δ֪Һ����������ζʱ��Ӧ�ý��Լ�ƿ�ھ���ڱ�ԶһЩ���������ᓁ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/LNaF��Һ�У�c��Na+����c��F-����c��H+����c��OH-�� |
| B��Na2SiO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ�pH��KW����С |
| C��pH=5��HF��Һ��pH=5��NH4NO3��Һ�У�c��H+������� |
| D����Na2S��Һ�м���AgCl���壬��Һ��c��S2-���½� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3-��-4-�һ����� |
| B��1��5-���ױ� |
| C��2-�һ�-1-��ϩ |
| D��3-��-2-��Ȳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��10��1 | B��1��10 |
| C��2��1 | D��1��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na2CO3 |
| B��Na2CO3��Na2O2 |
| C��NaOH |
| D��Na2CO3��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ͻ�Ӳ�ȱ����ĸ��ɷֽ����� |
| B���Ͻ��۵�����ĸ��ɷֽ����ĸ� |
| C���Ͻ���������Ļ�е���� |
| D���������������;���ĺϽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
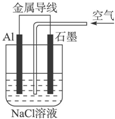
| A�����Ǹ�������Ƭ��������ɫ���� |
| B��ʯī��������ʯī������������ɫ���� |
| C����Һ�����缫�������ɫ���� |
| D����Һ���Ȳ�����ɫ�������������ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��X��Y��Z�����ڶ�����Ԫ�� |
| B�����Ӱ뾶X+��Y- |
| C��Y����̬�⻯����γ���� |
| D��X��Y��Z����Ԫ����ɵĻ������мȺ������Ӽ��ֺ��й��ۼ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com