
| A. | 升高温度 | B. | 降低温度 | C. | 通入氦气 | D. | 加入催化剂 | ||||
| E. | 移出氧气 |
分析 A.升高温度,平衡向吸热反应方向移动;
B.降低温度,平衡向放热反应方向移动;
C.恒温恒容下,通入氦气,反应混合物各组分浓度不变;
D.加入催化剂不影响平衡移动;
F.移走氧气,氧气浓度减小,平衡向生成氧气方向移动.
解答 解:发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.
A.正反应为放热反应,升高温度平衡逆向移动,SO2的转化率降低,故A错误;
B.正反应为放热反应,降低温度平衡正向移动,SO2的转化率增大,故B正确;
C.恒温恒容下,通入氦气,反应混合物各组分浓度不变,平衡不移动,SO2的转化率不变,故B错误;
D.加入催化剂加快反应速率,不影响平衡移动,SO2的转化率不变,故D错误;
E.移走氧气,氧气浓度减小,平衡逆向移动,SO2的转化率降低,故E错误,
故选:B.
点评 本题考查化学平衡影响因素,注意惰性气体对平衡移动影响本质:是否影响反应混合物各组分浓度变化.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中FeO42-是氧化产物 | |
| C. | 干法中每生成1 molNa2FeO4转移4mol电子 | |
| D. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 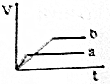 | B. | 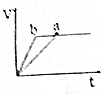 | C. |  | D. | 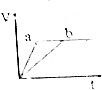 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热 | B. | 使用催化剂 | C. | 加压 | D. | 分离出D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+>Cu2+>Fe2+ | B. | Cu2+>Ag+>Fe2+ | C. | Ag+>Fe2+>Cu2+ | D. | Fe2+>Cu2+>Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 比NaHCO3 的溶解度大 | |
| B. | Na2CO3 比NaHCO3 稳定 | |
| C. | 物质的量相等的Na2CO3 和NaHCO3,前者质量大 | |
| D. | 物质的量相等的Na2CO3 和NaHCO3分别与足量盐酸反应得CO2 的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.
实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com