
| A. | Ag+>Cu2+>Fe2+ | B. | Cu2+>Ag+>Fe2+ | C. | Ag+>Fe2+>Cu2+ | D. | Fe2+>Cu2+>Ag+ |
科目:高中化学 来源: 题型:选择题
| A. | 偏铝酸钡 Ba(AlO2)2 | B. | 明矾 KAl(SO4)2•12H2O | ||
| C. | 醋酸钙 (CH3COO)2Ca | D. | 亚硫酸氢钙 CaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Z、W、Q三种元素的单质属于三种不同的晶体类型 | |
| B. | Q氢化物的熔点高于Z氢化物的熔点 | |
| C. | 一定条件下,Q单质可把Y从其氢化物中置换出来 | |
| D. | 最高价氧化物对应水化物的酸性顺序:Q>Y>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含MnO2的分散系中,K+、H2O2、S、Br--可以大量共存 | |
| B. | MnO2和浓盐酸反应的离子方程式:4HCl+MnO2═2Cl-+Cl2↑+Mn2++2H2O | |
| C. | MnO2在高锰酸钾的分解反应中是氧化产物 | |
| D. | 1 mol MnO2和参与反应:3MnO2+4Al═3Mn+2Al2O3,转移4 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低温度 | C. | 通入氦气 | D. | 加入催化剂 | ||||
| E. | 移出氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molFe2+被氧化时有1molO2被还原 | B. | 该反应中只有Fe2+是还原剂 | ||
| C. | 每生成1molFe3O4转移2mol电子 | D. | 反应方程式中化学计量数x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离程度 | B. | 酸的物质的量浓度 | ||
| C. | 与Zn反应开始时的反应速率 | D. | 与足量的Zn反应产生H2量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
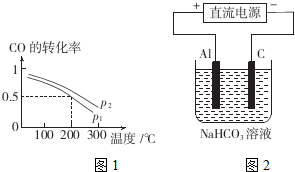
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
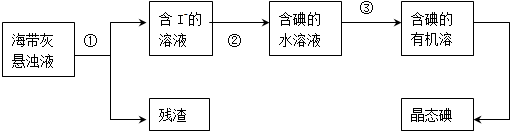
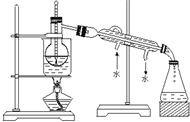
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com