
【题目】在一定体积的密闭容器中,进行如下化学反应:C(s)+H2O(g) ![]() CO(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(H2O)=5c(CO)·c(H2),试判断此时的温度为______。
(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(5)已知可逆反应CO2(g)+H2(g) ![]() CO(g)+H2O (g), k=3.5,1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
CO(g)+H2O (g), k=3.5,1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
【答案】 ![]() 吸热 700℃ 向正反应方向 向逆反应方向
吸热 700℃ 向正反应方向 向逆反应方向
【解析】(1)碳为固体,根据化学平衡常数表达式可得K=![]() ;(2)根据表中数据,由于温度升高,该反应的化学平衡常数增大,平衡向正反应方向移动,则正反应为吸热反应;(3)平衡浓度符合下式:3c(H2O)=5c(CO)·c(H2),则K=
;(2)根据表中数据,由于温度升高,该反应的化学平衡常数增大,平衡向正反应方向移动,则正反应为吸热反应;(3)平衡浓度符合下式:3c(H2O)=5c(CO)·c(H2),则K=![]() =
=![]() =0.6,则温度为700℃;(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,相当于减小了压强,平衡向气体体积增大的方向移动,故对于该反应而言,平衡向正反应方向移动;(4)由表可以看出,在830℃时,K为1.0,所以向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K仍然为1.0,因为温度不变,平衡常数不变;(5)若1200℃时,平衡常数K为2.6,因为CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4mol·L-1、4mol·L-1,其离子积为
=0.6,则温度为700℃;(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,相当于减小了压强,平衡向气体体积增大的方向移动,故对于该反应而言,平衡向正反应方向移动;(4)由表可以看出,在830℃时,K为1.0,所以向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K仍然为1.0,因为温度不变,平衡常数不变;(5)若1200℃时,平衡常数K为2.6,因为CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4mol·L-1、4mol·L-1,其离子积为![]() =4>2.6,所以此时上述反应的平衡移动方向为向逆反应方向移动。
=4>2.6,所以此时上述反应的平衡移动方向为向逆反应方向移动。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是
A. 1∶2 B. 2∶1 C. 2∶3 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的描述不符合事实的是
A.SO2可用作食品防腐剂B.金刚石是自然界中最硬的物质
C.亚硝酸盐可致癌,严禁用作防腐剂D.NO可用于某些疾病的治疗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2ONH4++OH-,若要使平衡向逆反应方向移动,应加入的物质或采取的措施是( )
A.NH4Cl固体B.硫酸C.水D.加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质用途及其原理都正确的是
选项 | 物 质 用 途 | 原 理 |
A | 高纯硅常作太阳能电池材料 | 硅是电的良导体 |
B | 草木灰与铵态氮肥混合使用能提高肥效 | 铵盐与K2CO3在水中发生双水解,有利于NH3逸出 |
C | 漂粉精用于漂白印染好的花 布布料 | HClO或 |
D | 可燃冰是一种具有潜力的清洁能源 | CH4完全燃烧,不产生烟尘 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.01mol·L-1的NaOH溶液中由水电离生成的H+浓度( )
A.0.01mol·L-1B.1×10-7mol·L-1C.1×10-12mol·L-1D.1×10-14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2 H2 ( g ) +O2 ( g )=2H2O ( g ) ΔH = -483.6 kJ/mol
N2 ( g ) +2O2 ( g )=2NO2 ( g ) ΔH = + 67.7 kJ/mol
则H2将NO2还原为N2的热化学反应方程式:___________________________
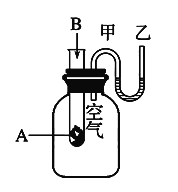
II、为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为_____(填“放热”或“吸热”)反应。ΔH___0(填>、<、=)
(2)A和B的总能量比C和D的总能量_____(填“高”或“低”)。
(3)物质中的______能通过化学反应转化成______能释放出来。
(4)反应物化学键断裂吸收的能量_____(填“高”或“低”)于生成物化学键形成放出的能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com