
| A、与乙醇反应时,NH5被氧化 |
| B、NH5中N元素的化合价为+5价 |
| C、1 mol NH5中含有5 molN-H键 |
| D、1 mol NH5与H2O完全反应,转移电子2 mol |
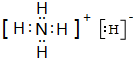 ,N元素的化合价为-3价,故B错误;
,N元素的化合价为-3价,故B错误;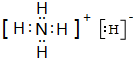 ,1 mol NH5中含有4molN-H键,故C错误;
,1 mol NH5中含有4molN-H键,故C错误;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、FeCl2 |
| B、CuSO4 |
| C、Na2CO3 |
| D、Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B、水电站把机械能转化成电能,而核电站把化学能转化成电能 |
| C、在医院中,为酸中毒病人输液应采用0.9%氯化铵溶液 |
| D、棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中失去电子的一极一定为负极 |
| B、电解池中与直流电源负极相连的一极一定为阴极 |
| C、电解池中发生氧化反应的一极一定为阳极 |
| D、原电池中负极的质量一定减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
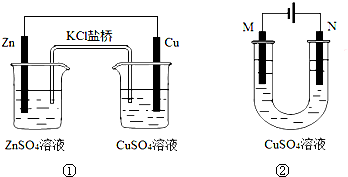
| A、装置①中盐桥内的K+移向CuSO4溶液 |
| B、装置①将电能转变为化学能 |
| C、若装置②用于铁棒镀铜,则N极为铁棒 |
| D、若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O+H2O=2NaOH | ||||
| B、2F2+2H2O=4HF+O2 | ||||
| C、C+H2O=CO+H2 | ||||
D、2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
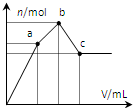 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法正确的( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法正确的( )| A、a点的溶液呈中性 |
| B、a点沉淀的质量比c点沉淀的质量大 |
| C、b点加入Ba(OH)2溶液的体积为250 mL |
| D、至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-→AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸溶液中加入氢氧化亚铁:Fe(OH)2+2H+=Fe2++2H2O |
| B、NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| C、FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl- |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com