
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。此过程中共消耗水( )
A.3 mol B.4 mol C.5 mol D.6 mol
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:填空题
乙醇的生产过程可由下图表示:
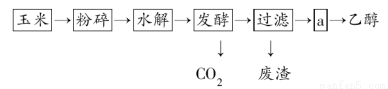
(1)粉碎玉米的目的是___________________________。
(2)生产过程中为了检验淀粉是否完全水解,可使用的试剂是________。
(3)步骤a的操作是( )
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:
______________________________________________。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+nH2O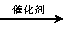 nC6H12O6
nC6H12O6
C6H12O6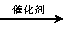 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
根据上述反应式,可以算出100kg淀粉理论上可生产无水乙醇________kg。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
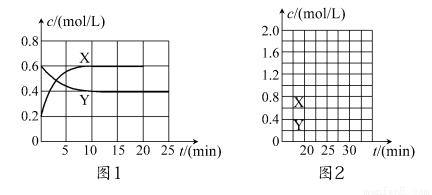
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而变化
(3)反应进行到10 min时,共吸收热量22.76 kJ,则该反应的热化学方程式为_________________________________;该反应的平衡常数K=________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为ω1,达到新平衡后混合气体中NO2的体积分数为ω2,则ω1________ω2(填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
在一定温度下,反应C(s)+H2O(g)  CO(g)+H2(g)达到平衡的标志是( )
CO(g)+H2(g)达到平衡的标志是( )
A.正反应与逆反应速率均为零
B.v(H2O生成)=v(CO消耗)
C.单位时间内反应物减少的分子数等于生成物增加的分子数
D.压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
下列反应中,Q2>Q1的是( )
A.H2(g)+F2(g)=2HF(g) ΔH=-Q1 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-Q1 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 kJ·mol-1
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-Q1 kJ·mol-1
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-Q2 kJ·mol-1
D.S(s)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1
S(g)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①:①③相连时,③为正极:②④相连时,②上有气泡逸出:③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是 ( )
A.①③②④ B.①③④② C.③④②① D.③①②④
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
化合物甲乙丙
各元素原子
个数比N(A):N(C)
=2:1N(A):N(C)
=1:1N(B):N(A)
=1:4
化合物丁戊己
各元素原子
个数比N(D):N(B):N(C)
=2:1:3N(E):N(F)
=1:3N(B):N(F)
=1:4
请完成下列问题:
(1)D的离子结构示意图为________,己的空间构型是________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为________ mol。
(3)8 g丙完全燃烧,生成液态水和CO2,放出445 kJ的热量,则丙燃烧的热化学方程式为________。
(4)F的单质与甲反应的离子方程式为________。
(5)将丁与戊两种水溶液混合,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
以下说法中,不违背科学规律的是( )
①改变核外电子数可使原子与离子相互转化 ②改变核内中子数可使不同的同位素相互转化 ③改变核内质子数可使不同的元素相互转化,属于化学变化 ④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
A.①② B.②③ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:选择题
下列解释实验现象的反应方程式正确的是 ( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl-
C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com