
下列有关胶体的说法正确的是( )
A.直径介于10-9 m~10-7m之间的微粒称为胶体
B.电泳现象可以证明胶体属于电解质
C.用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同
D.将Fe(OH)3胶体和泥水分别进行过滤,发现均不能通过滤纸
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是 (填字母序号)。
A. 将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。
B. 在FeCl3溶液中加入足量的NaOH溶液
C. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为 。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3 + 2KI = 2FeCl2 + I2 +2KI
在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 色,再将混合液倒入 (填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②通入的过量Y是CO2气体
D.图中所示的转化反应①②都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有关实验的说法正确的是
A.向盛有碘水的分液漏斗中加入无水乙醇,振荡、静置,放出有机层后再蒸馏,提取碘水中的碘
B.取淀粉、稀硫酸共热后的溶液与新制Cu(OH)2反应,无红色沉淀生成,说明淀粉未水解
C.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH
D.为除去粗盐中的Ca2+、Mg2+、SO42-,先后加入的试剂是H2O、Ba(OH)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了某冷轧厂排放的废水中各成份的含量及国家环保标准值的有关数据:
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
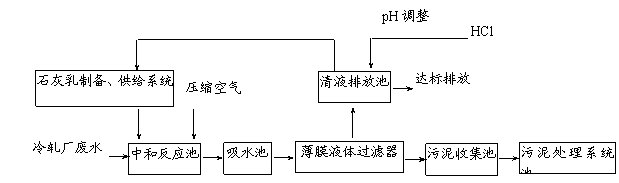 某科研机构为该厂量身定做,设计了如下废水处理系统,不但节约大量工业用水,而且大大降低了生产成本。
某科研机构为该厂量身定做,设计了如下废水处理系统,不但节约大量工业用水,而且大大降低了生产成本。
请回答下列问题:
⑴ 向中和反应池中通入压缩空气的作用是 ▲ 。
⑵ 若废水中细菌含量较高,往往用漂白粉代替石灰乳沉淀Zn2+,漂白粉沉淀Zn2+的离子方程式是
▲ 。
⑶ 污泥处理系统除去污泥后,可得到的工业副产品有 ▲ (填化学式)。
⑷ 薄膜液体过滤器是将膨体聚四氟乙烯专利技术与全自动控制系统完美地结合在一起的固液分离设备。为提高薄膜液体过滤器的过滤能力,废水处理系统工作一段时间后,需要对薄膜进行化学处理,薄膜定期处理的方法是 ▲ 。
⑸ 经上述工艺处理后的废水pH=8,此时废水中Zn2+的浓度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17), ▲ (填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是:( )
A.氯气通入水中,溶液呈酸性:Cl2+H2O  2H++Cl-+ClO-
2H++Cl-+ClO-
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.向明矾溶液中滴加Ba(OH)2溶液,达沉淀物质的量最大:
2Al3++3SO42-+3Ba2++6OH- = 2 Al(OH)3↓+3BaSO4↓
D.过量铁溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B.硫粉在过量的氧气中燃烧可以生成SO3
C.将少量SO2通入BaCl2溶液能生成白色沉淀
D.将浓盐酸、浓硝酸和浓硫酸分别露置在空气中,溶质的物质的量浓度都降低
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(III)的化学方程式 。
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,反应(III)的离子方程式为 。
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,则反应(III)中氧化产物与还原产物的物质的量之比为 。0.1mol A与含0.15 mol NaOH的溶液充分反应后,溶液中所含离子浓度的大小关系为 。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为 ,D的电子式为 。
②25℃时,0.1mol·L-1 B、C溶液,pH较大的是 溶液(填溶质的化学式),写出B溶液中微粒浓度之间存在的等量关系 (写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中错误的是
A.过滤操作时如果有必要可以用蒸馏水洗涤滤纸上的沉淀2-3次
B.蒸馏操作时,应使温度计水银球插入液态混合物中
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,要不断振摇分液漏斗并放气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com