
【题目】姜黄素的合成路线如图所示:
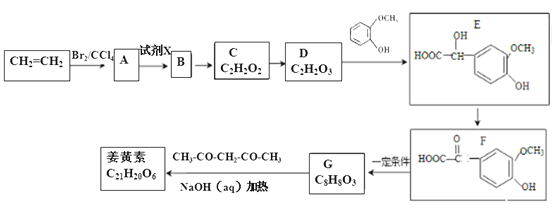
已知:①![]()
②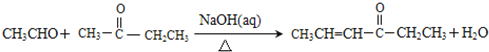
请回答下列问题:
(1)D中含有的官能团名称是__________,D→E的反应类型是__________。
(2)姜黄素的结构简式为__________。
(3)反应A→B的化学方程式为__________。
(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其结构简式为__________。
(5)下列有关E的叙述不正确的是__________(填序号).
a.能发生氧化、加成、取代和缩聚反应
b.1molE与浓溴水反应最多消耗3mol的Br2
c.E能与FeCl3溶液发生显色反应
d.1molE最多能与3molNaOH发生反应
(6)G香兰醛(C8H8O3)的同分异构体中,符合下列条件的共有__________种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为__________
①属于酯类;②能发生银镜反应;③苯环上的一取代物只有2种;
【答案】
(1)醛基、羧基;加成反应;
(2)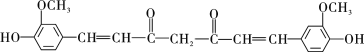
(3)![]() (前面写水,后面写HBr也对)
(前面写水,后面写HBr也对)
(4)![]() (不写端基也正确)
(不写端基也正确)
(5)bd
(6)3;![]()
【解析】
试题分析:乙烯和溴发生加成反应生成A为BrCH2CH2Br,由D的分子式与E的结构,可知D为OHC-COOH,H为![]() ,则A在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,C为OHC-CHO,C中部分醛基被氧化生成D.E发生催化氧化生成F,F在一定条件下发生信息①中脱羧反应生成G为
,则A在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,C为OHC-CHO,C中部分醛基被氧化生成D.E发生催化氧化生成F,F在一定条件下发生信息①中脱羧反应生成G为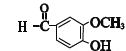 ,结合信息②及姜黄素的分子式,可知姜黄素的结构简式为:
,结合信息②及姜黄素的分子式,可知姜黄素的结构简式为: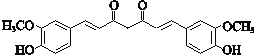 。
。
(1)D为OHC-COOH,含有的官能团名称是:羧基、醛基,D→E的反应类型是:加成反应,故答案为:羧基、醛基;加成反应;
(2)姜黄素的结构简式为: ,故答案为:
,故答案为: ;
;
(3)反应A→B的化学方程式为:BrCH2CH2Br+2NaOH![]() HOCH2CH2OH+2NaBr,故答案为:BrCH2CH2Br+2NaOH
HOCH2CH2OH+2NaBr,故答案为:BrCH2CH2Br+2NaOH![]() HOCH2CH2OH+2NaBr;
HOCH2CH2OH+2NaBr;
(4)D(OHC-COOH(的催化氧化产物为HOOC-COOH,与B(乙二醇)可以反应生成一种高分子化合物,其结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)有关E( )的叙述:a.含有醇羟基、酚羟基,能发生氧化反应,含有苯环,可以发生加成反应,含有羧基、醇羟基、酚羟基,可以发生取代反应,羧酸与醇羟基可以发生缩聚反应,故a正确;b.酚羟基邻位有H原子,可以与浓溴水发生取代反应,1mol E与浓溴水反应最多消耗1mol的Br2,故b错误;c.E中含有酚羟基,能与FeCl3溶液发生显色反应,故c正确;d.羧基、酚羟基能与氢氧化钠反应,1mol E最多能与2mol NaOH发生反应,故d错误,故选:bd;
)的叙述:a.含有醇羟基、酚羟基,能发生氧化反应,含有苯环,可以发生加成反应,含有羧基、醇羟基、酚羟基,可以发生取代反应,羧酸与醇羟基可以发生缩聚反应,故a正确;b.酚羟基邻位有H原子,可以与浓溴水发生取代反应,1mol E与浓溴水反应最多消耗1mol的Br2,故b错误;c.E中含有酚羟基,能与FeCl3溶液发生显色反应,故c正确;d.羧基、酚羟基能与氢氧化钠反应,1mol E最多能与2mol NaOH发生反应,故d错误,故选:bd;
(6)G( )的同分异构体符合条件的同分异构体:
)的同分异构体符合条件的同分异构体: ![]() 、
、![]() 、
、![]() , 其中核磁氢谱有4组吸收峰的结构为
, 其中核磁氢谱有4组吸收峰的结构为![]() ,故答案为:3;
,故答案为:3;![]() 。
。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】我国成功研制出丁苯酞,标志着我国在脑血管疾病治疗药物研究领域达到了国际先进水平。合成丁苯酞(J)的一种路线如下
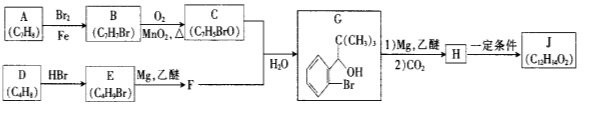
已知:①

②E的核磁共振氢谱只有一组峰;
③J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)对E的系统命名
(2)由B生成C反应类型为
(3)C中官能团名称为 ,C分子中最多有 个原子共平面。(已知甲醛中所有原子共面)
(4)由H生成J的化学方程式为 (写明反应条件)。
(5)![]() 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中:
①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。
满足上述条件X的同分异构体共有 种(不考虑超出中学范围的顺反异构和手性异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 。
(6)参考题中信息和所学知识,写出由甲醛和化合物A合成2一苯基乙醇(![]() )的路线流程图(其它试剂任选)。合成路线流程图表达方法例如下:
)的路线流程图(其它试剂任选)。合成路线流程图表达方法例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】已知:
![]()
![]() —C≡CH+—
—C≡CH+—![]() —H
—H![]() —C≡C—
—C≡C—![]()
—CHO+![]()
![]() —
—![]()
![]()
以乙炔为原料,通过下图所示步骤能合成有机中间体E(转化过程中的反应条件及部分产物已略去)。
![]()
![]() C2H2
C2H2![]() A
A![]() B
B![]() C
C![]() D
D![]() E:H—
E:H—![]()
![]()
![]() —H
—H
其中,A、B、C、D分别代表一种有机物,B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1)A生成B的化学反应类型是_________________。
(2)写出生成A的化学反应方程式_________________________________________。
(3)B在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比A小的有机产物的结构简式:_________________、__________________。
(4)写出C生成D的化学反应方程式:______________________________。
(5)含有苯环,且与E互为同分异构体的酯有___种,写出其中一种同分异构体的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着能源危机的加剧,我国也在大力推广新一代乙醇燃料,广西是我国甘蔗产量主产区之一,乙醇可以从甘蔗中提炼加工出来,乙醇除用作燃料外,还可以用它合成其他有机物。下面是以乙醇为起始原料的转化关系,请回答相关问题。
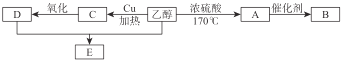
①B在日常生活中常用来作食品包装袋,但往往会带来环境问题。
写出A→B的化学方程式: 。
②写出乙醇→A的化学方程式: 。
③写出乙醇→C的化学方程式: 。
④写出E的方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】Ⅰ煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g)+H2O (g)H2 (g)+CO2 (g)平衡常数K随温度的变化如下表
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2 (g)2CO (g)平衡常数K1
C(s)+H2O (g)H2 (g)+CO (g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液的pH、体积相同的盐酸和醋酸两种溶液,下列叙述错误的是
A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH少
B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的n(Cl-)= n(CH3COO-)相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。

关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ②
2HI(g) = H2(g) + I2(g) H= c kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) H= kJ/mol
(2)CO2 和CH4 是两种重要的温室气体,以表面覆盖有Cu2Al2O4 的二氧化钛为催化剂。可以将CO2 和CH4直接转化为乙酸。
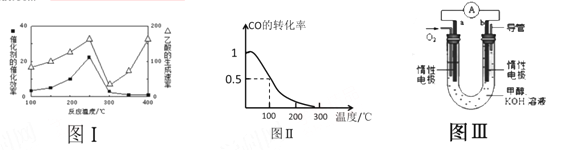
①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在 ℃左右。
②将Cu2Al2O4 溶解在稀硝酸中的离子方程式为 。
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2 在催化剂作用下反应生成甲醇:CO(g) + 2H2(g) ![]() CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是 (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g) ![]() CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH- 向 (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com