
【题目】随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ②
2HI(g) = H2(g) + I2(g) H= c kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) H= kJ/mol
(2)CO2 和CH4 是两种重要的温室气体,以表面覆盖有Cu2Al2O4 的二氧化钛为催化剂。可以将CO2 和CH4直接转化为乙酸。
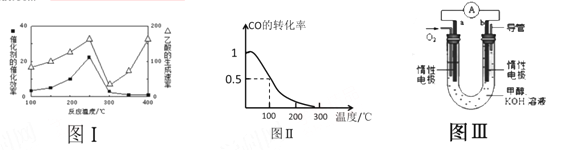
①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在 ℃左右。
②将Cu2Al2O4 溶解在稀硝酸中的离子方程式为 。
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2 在催化剂作用下反应生成甲醇:CO(g) + 2H2(g) ![]() CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是 (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g) ![]() CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH- 向 (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为: 。
【答案】(1)(2a+b+2c)
(2)①250 ②3Cu2Al2O4 + 32H+ + 2NO3- = 6Cu2+ + 6Al3+ + 2NO↑+ 16H2O
(3)①放热 ② 增大 ③a2/V2
(4)①b ② CH3OH + 8OH- - 6e- = CO32- + 6H2O
【解析】
试题分析:(1)①SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ①;2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ②;2HI(g) = H2(g) + I2(g) H= c kJ/mol ③,依据盖斯定律①×2+②+③×2得到2H2O(g)=2H2(g)+O2(g)△H=(2a+b+2c)kJ/mol.
(2)①根据图示可知,在250℃左右,催化剂的催化效率和乙酸的生成速率最大,因此该反应体系应将温度控制在250℃左右。
②Cu2Al2O4中Cu为+1价,Cu2Al2O4与硝酸生成硝酸铜、硝酸铝、NO和水,根据得失电子相等、电荷守恒、质量守恒配平,则Cu2Al2O4 溶解在稀硝酸中的离子方程式为3Cu2Al2O4 + 32H+ + 2NO3- = 6Cu2+ + 6Al3+ + 2NO↑+ 16H2O。
(3)①根据图像可知,温度升高,CO的转化率降低,说明平衡向逆反应方向移动,而升高温度,平衡向吸热反应方向移动,所以该反应为放热反应;
②该反应是气体体积缩小的可逆反应,在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,相当于增大压强,平衡向正反应方向移动,达到新平衡时,CO的转化率增大;
③100℃时,CO的转化率为0.5,设有a mol CO与2a mol H2 ,容器的体积为V,根据三段式
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始物质的量 a 2a 0
变化物质的量 0.5a a 0.5a
平衡物质的量 0.5a a 0.5a
K=(0.5a/V)÷[(a/V)2×0.5a/V]= V2/a2,反应逆向进行,平衡常数互为倒数,所以100℃,反应CH3OH(g) ![]() CO(g) + 2H2(g) 的平衡常数为a2/V2
CO(g) + 2H2(g) 的平衡常数为a2/V2
(4)①甲醇燃料电池,氧气得电子发生还原反应,在正极放电,a为正极,b为负极,阴离子移向负极,则该电池工作时,OH- 向b极移动;
②甲醇作燃料的电池示意图中,KOH作电解质,甲醇反应生成的二氧化碳与KOH反应生成碳酸钾,所以该电池负极反应的电极反应式为CH3OH + 8OH- - 6e- = CO32- + 6H2O。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
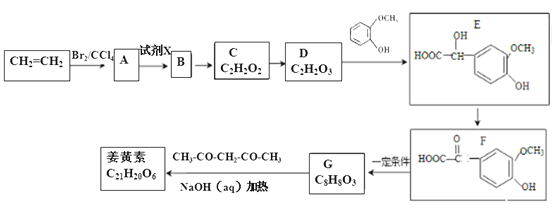
【题目】姜黄素的合成路线如图所示:
已知:①![]()
②
请回答下列问题:
(1)D中含有的官能团名称是__________,D→E的反应类型是__________。
(2)姜黄素的结构简式为__________。
(3)反应A→B的化学方程式为__________。
(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其结构简式为__________。
(5)下列有关E的叙述不正确的是__________(填序号).
a.能发生氧化、加成、取代和缩聚反应
b.1molE与浓溴水反应最多消耗3mol的Br2
c.E能与FeCl3溶液发生显色反应
d.1molE最多能与3molNaOH发生反应
(6)G香兰醛(C8H8O3)的同分异构体中,符合下列条件的共有__________种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为__________
①属于酯类;②能发生银镜反应;③苯环上的一取代物只有2种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (实验)某芳香烃A有如下转化关系:按要求填空:
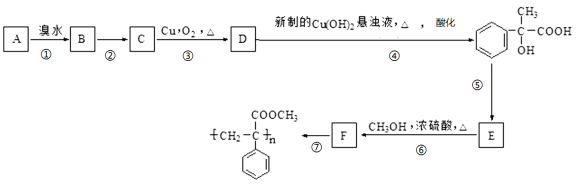
(1)写出D中所含官能团的名称 ,指出⑤的反应类型 。
(2)反应②的反应条件是 。
(3)写出A和F结构简式:A ;F 。
(4)写出反应③对应的化学方程式: 。
(5)写出D与新制Cu(OH)2悬浊液反应的化学方程式: 。
(6)E符合下列条件的同分异构体有多种,任写其中一种能同时满足下列条件的异构体的结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:

请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气对氢气的相对密度为30,则E的分子式为_______________。
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为 。
(3)由B生成D、由C生成D的反应条件分别是_______________、_______________。
(4)由A生成B、由D生成G的反应类型分别是_______________、_______________。
(5)F存在于栀子香油中,其结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题:
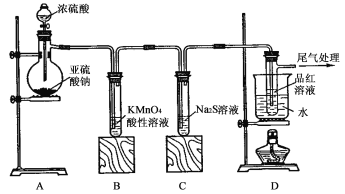
(1)装置A中盛放浓硫酸的仪器名称是____________________;
(2)实验过程中,装置B中发生的现象是 ,说明 SO2 具有 性;装置C中发生的现象是 ,说明 SO2 具有 性;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象: ;
(4)尾气可采用 溶液吸收,反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、NH3、H2O和HF均为含10e﹣的分子。
(1)N、O、F三种元素中,与基态C原子的核外未成对电子数相等的元素是 (写元素名称),其基态原子的价层电子排布图为 。
(2)C、N、O、F四种元素第一电离能由大到小的顺序是 (用元素符号表示)。
(3)CH4、NH3和H2O分子中,从原子轨道的重叠方向来说,三种分子均含共价键类型为 ,三种分子的中心原子的杂化轨道类型均为 。
(4)CH4燃烧生成CO、CO2和H2O。
①在CO气流中轻微加热金属镍(Ni),生成无色挥发性液态Ni(CO)4,试推测四羰基镍的晶体类型为 。
②OCN﹣与CO2互为等电子体,则OCN—结构式为 。
(5)与碳同族的硅形成的硅酸盐结构中的基本结构单元为[SiO4]四面体,由两个结构单元通过共用一个原子形成的硅酸盐阴离子的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环(如左图):
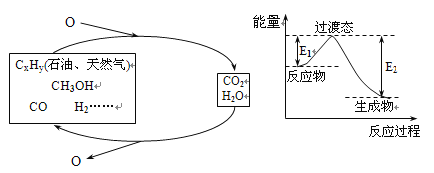
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气。右图是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ)分别是:
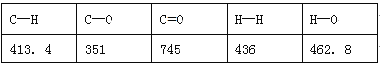
已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
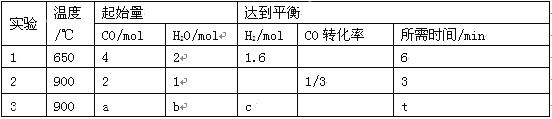
① 该反应的△H___________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为1/3,则a/b=______,c=____。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” ,“>” ,“=”)
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/L Na2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是____________________________。
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
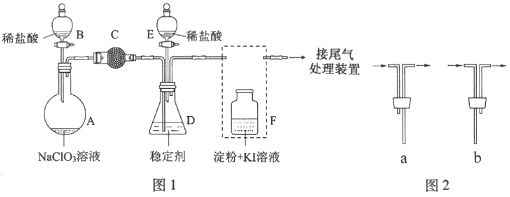
(1)仪器D的名称是___________,安装F中导管时,应选用图2中的___________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___________。
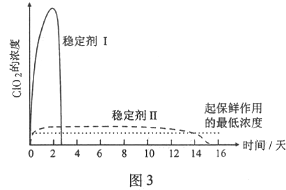
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是___________,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g) + 3H2(g)![]() 2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
A.N2、H2完全转化为NH3
B.N2、H2、NH3在容器中共存
C.反应已达到化学平衡状态
D.N2、H2、NH3的浓度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com