
【题目】![]() 表示阿伏加德罗常数的值,下列说法中正确的是( )
表示阿伏加德罗常数的值,下列说法中正确的是( )
A. ![]() 与足量
与足量![]() 完全反应时转移电子数为
完全反应时转移电子数为![]()
B. ![]() 二氧化硅中含有
二氧化硅中含有![]() 键为
键为![]()
C. 56g铁与1mol氯气发生反应转移电子数为3NA
D. 含![]() 的浓盐酸与足量
的浓盐酸与足量![]() 在一定条件下反应生成
在一定条件下反应生成![]() ,转移电子数为
,转移电子数为![]()
【答案】B
【解析】
A项、1molNa2O2与足量CO2完全反应生成碳酸钠和氧气,Na2O2既是氧化剂又是还原剂,转移电子数目为NA,故A错误;
B项、SiO2中每个Si原子与4个O原子形成4个Si—O键,则1molSiO2中含有Si—O键为4NA,故B正确;
C项、56gFe的物质的量为1mol,在1.5molCl2中燃烧生成FeCl3,则1molCl2不足量完全反应,反应转移电子数目为2NA,故C错误;
D项、浓盐酸与二氧化锰共热生成氯气,稀盐酸与二氧化锰共热不反应,随着反应进行,浓盐酸浓度减小,不可能完全反应,则含4molHCl的浓盐酸不可能完全反应,转移的电子数目小于2NA,故D错误;
答案选B。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
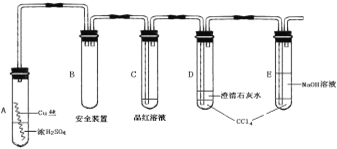
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S = Cu2S(黑色)。
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______________。
(2)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_______________。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:______________。设计实验验证你的猜想_____________。
(5)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_______。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe2+、Fe3+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
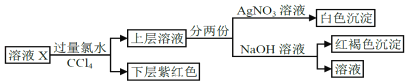
A. “下层紫红色”为I2的CCl4溶液,可用分液方法分离
B. 溶液X中有Fe2+、I﹣,可能有SO42﹣、Cl﹣、K+、Na+
C. 溶液X中一定有I﹣、Cl﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
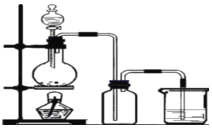
【题目】实验室制备氯气并检验氯气性质实验的装置如图。请回答:
(1)分液漏斗中盛放的液体是_____;写出圆底烧瓶中发生的反应的化学方程式_____。
(2)在集气瓶中放入湿润的红布条,滴加液体到烧瓶中,并点燃酒精灯,一段时间后集气瓶中观察到的现象是_____,烧杯中的液体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是二氧化氯(ClO2)泡腾片的主要成分。实验室以氯酸钠(NaClO3)为原料先制得ClO2,再制备NaClO2粗产品,其流程如图:
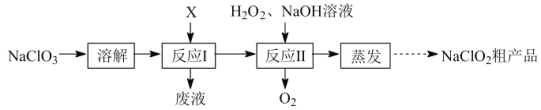
已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为___。
(2)实验在如图-1所示的装置中进行。
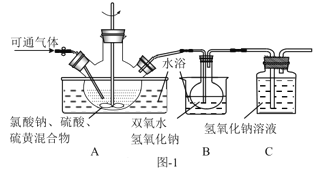
①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为___(填字母)。
②反应Ⅱ中双氧水的作用是___。保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的操作有:装置A中分批加入硫黄、___(写出一种即可)。
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为___(填“减压”、“常压”或“加压”)。
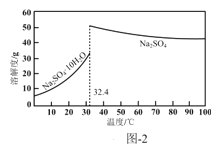
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:___,将滤液进一步处理后排放(实验中须使用的试剂和设备有:CaO固体、酚酞、冰水和冰水浴)。已知:CaSO4不溶于Na2SO4水溶液;Na2SO4的溶解度曲线如图2所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
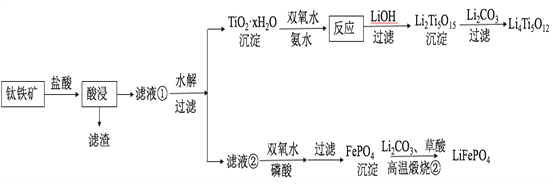
回答下列问题:
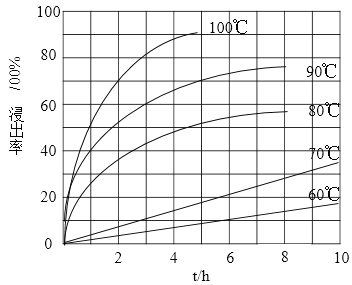
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
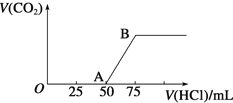
A. OA段所发生反应的离子方程式:H+ + OH-= H2O
B. 产生的CO2体积(标准状况下)为0.056L
C. 原NaOH溶液的物质的量浓度为0.75mol·L-1
D. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1molH2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-→H2O+IO-(慢)、 H2O2+IO-→H2O+O2+I-(快)。 下列有关该反应的说法不正确的是( )
A. 总反应中![]() :
:![]() :1
:1
B. ![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C. 该反应的催化剂是![]() ,而不是
,而不是![]()
D. 由于催化剂的加入降低了反应的活化能,使该反应活化能低于![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com