
| 元素 | A | B | C | D |
| 性质或 结构 信息 |
室温下单质为黄色粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 | 单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体 | 原子最外电子层有4个电子;其单质既能与酸反应,又能与碱反应 |


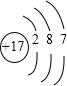 ,电子层数=周期数,最外层电子数=主族族序数,所以是第三周期第ⅦA族元素;Na与氧气燃烧后产物为Na2O2,电子式是
,电子层数=周期数,最外层电子数=主族族序数,所以是第三周期第ⅦA族元素;Na与氧气燃烧后产物为Na2O2,电子式是 ,故答案为:第三周期第第ⅦA族;
,故答案为:第三周期第第ⅦA族; ;
;

科目:高中化学 来源:不详 题型:填空题
| 元素 | A | B | C | D |
| 性质或 结构 信息 |
室温下单质为黄色粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 | 单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体 | 原子最外电子层有4个电子;其单质既能与酸反应,又能与碱反应 |
查看答案和解析>>
科目:高中化学 来源:呼和浩特一模 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省大理实验中学高一(下)期中化学试卷(解析版) 题型:解答题
| 元素 | A | B | C | D |
| 性质或 结构 信息 | 室温下单质为黄色粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体 | 单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰,生成淡黄色的固体 | 原子最外电子层有4个电子;其单质既能与酸反应,又能与碱反应 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年内蒙古呼和浩特市高三(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com