
分析 如硫酸亚铁变质,被氧化生成硫酸铁,可用KSCN检验,配制硫酸亚铁溶液时,为除去硫酸铁杂质,可用铁除杂,发生氧化还原反应生成硫酸亚铁,以此解答该题.
解答 解:若硫酸亚铁变质,亚铁离子会被氧化成铁离子,可使用硫氰化钾溶液检验,方法为:取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;如果变质,硫酸亚铁溶液中存在硫酸铁,为了不引进新的杂质,可以向硫酸亚铁溶液中加入少量的铁粉,将铁离子还原成亚铁离子,
故答案为:取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;配制硫酸亚铁溶液时,在溶液中加入少量还原铁粉.
点评 本题考查物质的检验、鉴别和提纯,为高频考点,侧重考查铁离子和亚铁离子的检验、物质的除杂与提纯、铁盐与亚铁盐的转变,题目难度中等,注意熟练掌握铁离子、亚铁离子的检验方法,明确除杂时不能引进新的杂质.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
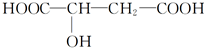 .苹果酸可能发生的反应是( )
.苹果酸可能发生的反应是( )| A. | 只有①②③ | B. | 只有②③④ | C. | 只有①②⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 将铝片改为铝粉,做铝与氧气反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com