
(1).
下列有关电化学的图示中,完全正确的是________
(2).
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中可与碘化物作用生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.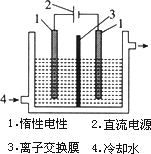
请回答下列问题:
a.碘是________(填颜色)固体物质,实验室常用________方法来分离提纯含有少量泥沙杂质的固体碘.
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH![]() 5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
电解时,阳极上发生反应的电极反应式为________,每生成1 mol KIO3,电路中通过的电子的物质的量为________.
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表.
![]()
可供选择的试剂有淀粉溶液,稀硫酸,氯化钠溶液,酒精等.(用其中的一种或多种均可.)
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是________,步骤⑤的操作名称是________.步骤④洗涤晶体的目的是________.
科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁及其化合物之间的相互转化可用下式表示:①②③④
铁及其化合物之间的相互转化可用下式表示:①②③④| ① |
| ④ |
| ② |
| ③ |
2- 4 |
查看答案和解析>>
科目:高中化学 来源:2010年福建省福州高级中学高二第二学期期末考试化学试题 题型:填空题
(附加题)(8分)铁及其化合物之间的相互转化可用下式表示: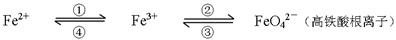
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
A.Cl2 B.Fe C.HNO3 D.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2 + 4Fe3+ = Cu2+ + 5Fe2+ + 2S。(CuFeS2中S为—2价)
则下列说法正确的是 (选填序号);
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2既作氧化剂又作还原剂
D.当转移1mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2 :1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3胶体。高铁酸钾作为水处理剂发挥的作用是_______、_________。
查看答案和解析>>
科目:高中化学 来源:2013届山东省新泰市汶城中学高三12月月考化学试卷(带解析) 题型:填空题
(6分)铁及其化合物之间的相互转化可用下式表示: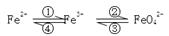
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是 (选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e- 时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)铁元素在周期表中的位置是___________________________。
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
A.Cl2 B.Fe C.HNO3 D.H2O2
(3)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价),下列说法正确的是________(选填序号)。
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2 既作氧化剂又作还原剂
D.当转移1 mol电子时,46 g CuFeS2参加反应
(4)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(5)向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体, 该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如右图所示。则混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为__________。

(6)某同学将铁与水蒸气高温反应后的固体物质溶解在过量盐酸中,如何判断所得溶液中是否含有Fe3+ ? ___________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com