
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2min后,测得D的浓度为
xC(g)+2D(g)。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
①x的值是__________;
②B的平均反应速率是____________;
③A在2min末的浓度是________________。
【答案】2 0.125mol/(L·min) 0.75mol/L
【解析】
由C的反应速率是![]() mol/(L·min)可知,2min末C的浓度为
mol/(L·min)可知,2min末C的浓度为![]() mol/(L·min) ×2min=0.5mol/L,设起始A和B的物质的量为amol/L,由题给数据建立如下三段式:
mol/(L·min) ×2min=0.5mol/L,设起始A和B的物质的量为amol/L,由题给数据建立如下三段式:
3A(g)+B(g) ![]() xC(g)+2D(g)
xC(g)+2D(g)
起(mol/L) a a 0 0
变(mol/L) 0.75 0.25 0.5 0.5
平(mol/L) a—0.75 a—0.25 0.5 0.5
①由三段式可知,C和D的浓度变化量之比为0.5mol/L:0.5mol/L=1:1,因物质的变化量之比等于化学计量数之比,则x:2=1:1,解得x=2,故答案为:2;
②由三段式可知,B的浓度变化量△c(B)=![]() =
=![]() = 0.125mol/(L·min),故答案为:0.125mol/(L·min);
= 0.125mol/(L·min),故答案为:0.125mol/(L·min);
③由2min末c(A):c(B)=3:5可得关系式:(a—0.75):(a—0.25)=3:5,解得a=1.5,则A在2min末的浓度为(1.5—0.75)mol/L=0.75 mol/L,故答案为:0.75 mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于反应11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4,1 mol P参加反应转移的电子数为______,被氧化的磷与被还原的磷的质量比为______,1 mol CuSO4可以氧化______mol的磷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)![]() 2CO(g)平衡常数K的表达式:K=___;
2CO(g)平衡常数K的表达式:K=___;
(2)已知某温度下,反应2SO2(g)+O2(g)![]() 2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g)![]() cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
(4)在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
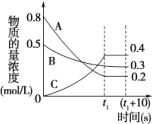
①该反应的化学方程式为:___;
②t1s时反应物A的转化率为:___;
③0~t1s内A的反应速率为v(A)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2O82-具有强氧化性,其还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为_________。1克CH4完全燃烧生成CO2(g)和H2O(l)时,放出Q kJ的热量。写出表示CH4燃烧热的热化学方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下HClO的Ka=4.7×10-8,在c(H2SO3)+c(HSO![]() )+c(SO
)+c(SO![]() )=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
)=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
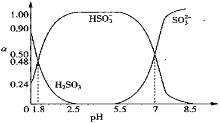
A.pH=7.2时,混合溶液中由水电离的c(H+)=10-7.2
B.等浓度的Na2SO3溶液pH比NaClO溶液的大
C.将等浓度、等体积的NaClO和Na2SO3溶液混合,混合液接近中性
D.Na2SO3溶液中:c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
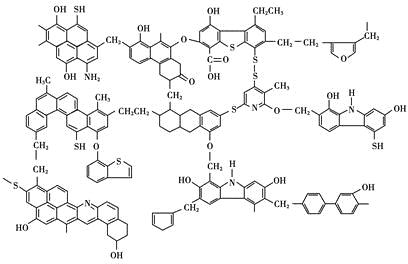
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com