
【题目】下列关于电解质的叙述中,不正确的是( )
A. 不只是酸、碱、盐类物质才属于电解质
B. 氯化钠溶液在电流作用下电离为钠离子与氯离子
C. 电解质未必能导电,能导电的也未必是电解质
D. 硫酸钡的水溶液虽导电性极弱,但硫酸钡是强电解质
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】有机化合物种类繁多,性质各异。下列有关常见有机物的描述中正确的是
A. 所有的糖、油脂、蛋白质在一定条件下均能发生水解反应
B. 苯、溴苯、硝基苯、乙酸乙酯均不溶于水
C. 用NaOH溶液不能区分![]() 和CH3COOCH2CH3
和CH3COOCH2CH3
D. 与Na反应的剧烈程度:CH3COOH>CH3CH2OH>H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报导,我国已研制出“可充室温钠一二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 充电时碳纳米管接直流电源的正极
C. 放电时每消耗3molCO2,转移12mol电子
D. 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将下列污染原因与结果用线连接起来:
A.氟里昂等排放物 a.酸雨
B.砍伐森林 b.土壤和水污染
C.核污染 c.放射病和癌症发病率增加
D.汽车、燃煤等排放SO2 d.臭氧层破坏
E.大量使用农药 e.土地沙漠化
_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)
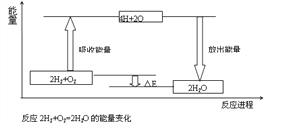
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述数据回答:
下表的数据是破坏1mol物质化学键所消耗的能量(kJ)

(1)表氢化物中本身具有的能量最高的是________,最稳定的是_______。
(2)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______
(3)相同条件下,X2(X代表Cl、Br、I)分别与等物质的量氢气反应时放出或吸收能量最多的是 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是科学探究的重要途径,请根据如图回答相关问题:
(1)A的仪器名称是___________;
(2)B可收集的一种气体是___________(写化学式);
(3)用C装置制取氧气的化学方程式_______________________________;
(4)D所示的蒸发操作中,用玻璃棒搅拌的目的是_____________________;
(5)E表示铁丝在氧气中燃烧,图中实验操作可能会导致的后果是_______________;
(6)F表示称量固体氢氧化钠的质量,出现的错误是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有上百种化合物,污染物中以NO为主。请回答下列与NO相关的问题:
(1)汽车发动机工作时燃料燃烧会使氮气转化为NO。
已知:N2(g)+O2(g)=2NO(g) △H=+akJ·mol-1。NO中氮氧键键能为b kJ·mol-1、O=O键能为 c kJ·mol-1。
计算N_N的键能为____________kJ·mol-1(用含a、b、c的代数式表示)。
(2)NO和CO在一定温度和催化剂的条件下可发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-538 kJ·mol-1。
N2(g)+2CO2(g) △H=-538 kJ·mol-1。
一定温度下,向体积为2L的密闭容器中充入一定量的NO和CO,发生上述反应。反应过程中测定的部分数据见下表:
时间/min | n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol |
0 | 0.100 | 0.200 | 0 | 0 |
4 | 0.020 | |||
6 | 0.050 | |||
8 | 0.025 |
①反应在0~4 min内的平均速率v(CO)=_____________。
②下列叙述中,能说明反应已达到平衡的是____________。
a.NO的消耗速率和CO2的生成速率相等 b.容器内的压强不再变化
c.混合气体的密度不再变化 d.N2的百分含量不再变化
③计算该温度下的平衝常数K=____________。
④8min时,其他条件不变,向该反应容器中再通入0.05molNO和0.100CO,重新达到平衡时混合气体中N2的百分含量将____________(填“减小”、“增大”或“不变” )。
(3)工业上采用电解NO的方法制备NH4NO3,其工作原理如图。X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充NH3。
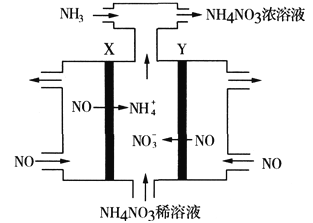
①Y电极上的电极反应式为_______________________________。
②若X电极上有11.2L(已换算成标准状况)NO发生反应,则生成NH4NO3的质量为____________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com