
【题目】常温时可以用铁制器皿存放的酸是
A. 稀硫酸 B. 稀醋酸 C. 浓盐酸 D. 浓硝酸
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】在原子的第n电子层中,当它属于最外层电子层时,最多容纳的电子数目与n-1层相同,当它属于次外层时,最多容纳的电子数比n+1层最多容纳的电子数多10个电子,则此电子层是 ( )
A. K层 B. L层 C. M层 D. N层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态卤代烃RX(R是烷基,X是某种卤素原子)的密度是a g/cm3。该RX在稀碱溶液中可以发生水解反应生成有机物ROH(ROH能与水互溶)和HX。为了测定RX的相对分子质量,进行了如下实验操作:
①准确量取该卤代烃bmL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀HNO3溶液酸化,滴加过量AgNO3溶液,得到白色沉淀。
④过滤、洗涤、干燥后称重,得到cg固体。
回答下列问题:
(1)步骤④中,洗涤的目的是为了除去沉淀上吸附的___________离子。
(2)该卤代烃中所含卤素的名称是____________,判断的依据是_________________。
(3)该卤代烃的相对分子质量是______________________(列出算式)。
(4)如果在步骤②中,加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c____(填写下列选项代码)。
A.偏大 B.偏小 C.不变 D.无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有相同的化学键类型的是 ( )
A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CH4D.Na2O2、H2O2、H2O、O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池原理如图所示,电池总反应为Zn+2NH4+═Zn2++2NH3↑+H2↑.下列说法正确的是( ) 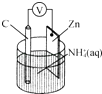
A.碳电极上发生还原反应
B.Zn极上发生还原反应
C.常见锌锰干电池为二次电池
D.负极上发生的反应为2NH4++2e﹣═2NH3↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题(答题时用具体元素符号表示). 
(1)用数字标注的元素中原子半径最小的是 , 半径最大的是 , 化学性质最稳定的是 , 非金属性最强的是 , 最高价氧化物对应的水化物酸性最强的是 .
(2)③最高价氧化物的结构式 , ⑦单质在⑤单质中燃烧生成物的电子式
(3)工业制取单质⑦的化学方程式 , 实验室制取单质⑨的化学方程式 , 单质⑧与单质⑦的最高价氧化物对应的水化物的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应在体积为2升的密闭容器中进行反应(A,B,C均为气体),在不同反应时间各物质的量的变化情况如图所示.则: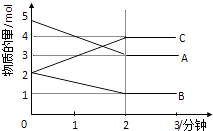
(1)该反应的化学方程为
(2)反应开始至2分钟,A的平均反应速率为
(3)反应开始至2分钟,A的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O含有的分子数是NA
B.常温常压下,NA个CO2占有的体积为22.4L
C.1.06克Na2CO3含有Na+数为0.02NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: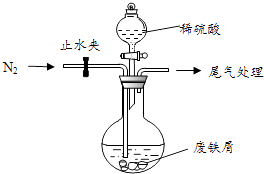
(1)【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备FeSO47H2O晶体,步骤如下:
①预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是 , 然后将废铁屑用水洗涤2~3遍.
②将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2 , N2的作用是 .
③再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为 .
④获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, , . 滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存.
(2)【测定FeSO47H2O含量】
①称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、胶头滴管、烧杯、量筒外,还需要的仪器有(填仪器名称)、 . 胶头滴管,250ml容量瓶…
②准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是 .
③用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO47H2O的质量分数为 . (已知Mr(FeSO47H2O)=278)
④若测量结果偏小,则可能是在定容时(填“俯视”或“仰视”)读数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com