
| ���� | H2 | CO | CH4 | CH3COOH |
| ȼ���ȣ�kJ/mol�� | 286 | 283 | 890 | 874 |
���� ��1��һ���¶��£����ݻ��㶨Ϊ2L���ܱ�������ͨ��3molCO2��3molCH4����Ӧ��2minĩ�ﵽƽ��״̬����ʱ���CO2��CO�����������ȣ���
CO2��g��+CH4 ��g��?2CO ��g��+2H2��g��
��ʼ����mol����3 3 0 0
�仯����mol����x x 2x 2x
ƽ������mol����3-x 3-x 2x 2x
��3-x=2x�����x=1��
�ٸ���v=$\frac{��c}{��t}$����v��H2����
�ڸ���K=$\frac{{c}^{2}��CO����{c}^{2}��{H}_{2}��}{c��C{O}_{2}����c��C{H}_{4}��}$����ƽ�ⳣ����
�ۿ��淴Ӧ����ƽ��ʱ��ͬ�����ʵ�������������ұ��ֲ��䣬����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣻
�ܢ�����ȼ���ȵ��Ȼ�ѧ����ʽ��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286kJ/mol ��
COȼ���ȵ��Ȼ�ѧ����ʽ��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283kJ/mol ��
CH4ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890kJ/mol ��
���ݸ�˹���ɣ���-�ڡ�2-�١�2�ɵã�CO2��g��+CH4��g��?2CO��g��+2H2��g����
��Ϊ���CH4��ת���ʣ�Ӧ�ı�����ʹƽ�������ƶ������ƽ�ⳣ�ƶ�ԭ��������𣬲���ֻ�������Ũ�ȣ�������ת���ʻή�ͣ�
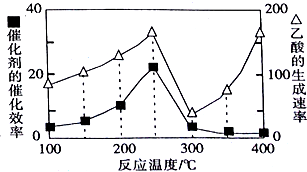
��2�����¶ȳ���250��ʱ���¶����ߴ����Ĵ�Ч�ʽ��ͣ�250��300��֮�����ΪӰ�췴Ӧ������Ҫ���أ��¶ȸ���300����¶���Ӱ�췴Ӧ������Ҫ���أ�
�ڴ��ۺϾ���Ч�濼�ǣ�250��ʱ�����Ĵ�Ч����ã�����¶Ⱥķѽϸߵ����������ҵ�������������ƽ����������Ӧ�����ƶ���
��� �⣺��1��һ���¶��£����ݻ��㶨Ϊ2L���ܱ�������ͨ��3molCO2��3molCH4����Ӧ��2minĩ�ﵽƽ��״̬����ʱ���CO2��CO�����������ȣ���
CO2��g��+CH4 ��g��?2CO ��g��+2H2��g��
��ʼ����mol����3 3 0 0
�仯����mol����x x 2x 2x
ƽ������mol����3-x 3-x 2x 2x
��3-x=2x�����x=1��
��v��H2��=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/��L��min�����ʴ�Ϊ��0.5mol/��L��min����
�ڸ��¶��£�ƽ�ⳣ��K=$\frac{{c}^{2}��CO����{c}^{2}��{H}_{2}��}{c��C{O}_{2}����c��C{H}_{4}��}$=$\frac{{1}^{2}��{1}^{2}}{1��1}$=1���ʴ�Ϊ��1��
�ۢ�CO2��g��+CH4��g��?2CO��g��+2H2��g������Ӧ�������������ķ�Ӧ��
A������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�2��v����CH4��=v����H2������2v����CH4��=v����H2������Ӧ�ﵽƽ��״̬����v����CH4��=2v����H2������������֮�ȣ�����˵����Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ���������ʵ����仯�����º�����ѹǿ�����仯����������ѹǿ���ֺ㶨���䣬˵����Ӧ�ﵽƽ��״̬����B��ȷ��
C����Ӧ�ж���4molC-H��ͬʱ����1mol H2ʱ��Ӧ�ﵽƽ��״̬����Ӧ�ж���2molC-H��ͬʱ����1mol H2��˵����Ӧ�ﵽƽ��״̬����C��ȷ��
D����Ӧǰ������������������䣬�����ڻ��������ܶ�ʼ�ձ��ֺ㶨���䣬����˵����Ӧ�ﵽƽ��״̬����D����
��ѡ��BC��
������ȼ���ȵ��Ȼ�ѧ����ʽ��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286kJ/mol ��
COȼ���ȵ��Ȼ�ѧ����ʽ��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283kJ/mol ��
CH4ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890kJ/mol ��
���ݸ�˹���ɣ���-�ڡ�2-�١�2�ɵã�CO2��g��+CH4��g��?2CO��g��+2H2��g����H=+248kJ/mol��
�ʴ�Ϊ��+248kJ/mol��
������Ӧ�������������ķ�Ӧ���ȷ�Ӧ����С��Ӧѹǿ������CO2��Ũ�ȡ������¶ȵȣ�ƽ�������ƶ�����Ӧ������ת��������
�ʴ�Ϊ����С��Ӧѹǿ������CO2��Ũ�ȣ�
��2�����¶ȳ���250��ʱ���¶����ߴ����Ĵ�Ч�ʽ��ͣ�250��300��֮�����ΪӰ�췴Ӧ������Ҫ���أ�������������ʽ��ͣ����¶ȸ���300����¶���Ӱ�췴Ӧ������Ҫ���أ�����������������¶����߶����ߣ�
�ʴ�Ϊ���¶ȳ���250��ʱ���¶����ߴ����Ĵ�Ч�ʽ��ͣ�250��300��֮�����ΪӰ�췴Ӧ������Ҫ���أ�������������ʽ��ͣ����¶ȸ���300����¶���Ӱ�췴Ӧ������Ҫ���أ�����������������¶����߶����ߣ�
�ڹ�ҵ�����и÷�Ӧ���¶ȳ�ѡ��250�桢��ѡ��400�棬���ۺϾ���Ч�濼�ǣ�����Ϊ250��ʱ�������Ĵ�Ч����ã�����¶Ⱥķѽϸߵ����������ҵ�������������ƽ����������Ӧ�����ƶ���
�ʴ�Ϊ��250�森
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧƽ��ͼ��ƽ��״̬�жϡ���Ӧ���ʡ�ƽ�ⳣ������Ӧ�ȼ���ȣ��ۺ���ǿ���Ƕ�ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȳʺ�ɫ����Һ�У�Fe2+��Cl-��NO3-��Na+ | |
| B�� | ʯ�����ɫ����Һ�У�K+��AlO2-��SiO32-��HSO3- | |
| C�� | ������Al3+����Һ�У�K+��Ca2+��NO3-��HCO3- | |
| D�� | ������OHһ����Һ�У�CO32-��ClO3-��F-��K+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Ư���ԣ��������ޡ��顢ֽ�ź�ʳƷ��Ư�� | |
| B�� | ���������ܽ���ˮ������������Һ��PM2.5�������ж����ЧӦ | |
| C�� | ��ˮ���ڻ�����Һ��������������ڴ����� | |
| D�� | SiO2���ܺ�NaOH��Һ��Ӧ���ܺ�����ᷴӦ������������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3A��g��+B��g��?2C��g������H��0 | B�� | A��g��+3B��s��+2C��g��?3D��g������H��0 | ||
| C�� | C��s��+D��g��?A��g��+B��g����H��0 | D�� | 2C��g��?2A��g��+B��g����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڲ��� | B�� | �ۢܲ��� | C�� | �٢ܲ��� | D�� | ȫ����ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����p% | B�� | ����p% | C�� | С��p% | D�� | ���ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol/L Na2CO3��Һ��c��OH-��=c��HCO3-��+c��H+��+c��H2CO3�� | |
| B�� | �����£�NH4Cl��NH3•H2O�����Һ��PH=7��c��NH4+ ��=c��Cl-�� | |
| C�� | �������Һ�м������������ƣ��õ��ļ��Ի����Һ��c��Na+����c��CH3COO-����c��H+����c��OH-�� | |
| D�� | �����£����������Һ�еμ�ϡ����õ���pH=5�Ļ����Һ��c��K+����c��NO3-�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com