
【题目】洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,漂白粉的有效成分是(填化学式)有关化学反应方程式为 .
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 .
(3)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则相同状况下10L O3与L Cl2的消毒能力相当.
【答案】
(1)Ca(ClO)2;2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O
(2)Ca(ClO)2+CO2+H2O═CaCO3↓+2 HClO
(3)30
【解析】解:(1)利用石灰乳和氯气反应生成氯化钙、次氯酸钙的混合物来制备漂白粉,发生反应:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,漂白粉的有效成分是Ca(ClO)2 , 所以答案是:Ca(ClO)2;2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;(2)置露在空气的漂白粉中的有效成分次氯酸钙与二氧化碳、水的反应生成具有漂白作用的次氯酸,即Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,所以答案是:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO;(3)相同条件下,气体的体积之比等于物质的量之比;消毒能力强弱与转移的电子数有关,若消毒能力相当,说明转移的电子数相等,所以若10L臭氧转移的电子数,需要氯气转移相同的电子数的体积为: ![]() L=30L,所以答案是:30.
L=30L,所以答案是:30.
【考点精析】通过灵活运用氯气的化学性质,掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应即可以解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】《本草经集注》中记载有关于区别硝石(KNO3)和朴硝(Na2SO4) 的方法:“强烧之,紫青烟起,…,云是真硝石也。”文中区别的方法是利用了下列中的( )
A. 焰色反应 B. 萃取 C. 丁达尔效应 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以 0.1000 mol·L-1 的 NaOH 溶液滴定 20.00mL 未知浓度的稀盐酸,滴定操作可分解为如下几步(所用的仪器已检漏且刚用蒸馏水洗净):
A.用酸式滴定管向锥形瓶里注入 20.00mL 待测稀盐酸溶液,并加入 2~3 滴酚酞;
B.用标准 NaOH 溶液润洗碱式滴定管 2~3 次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.将标准 NaOH 溶液注入碱式滴定管至刻度 0 以上 2~3cm ;
E.调节液面至 0 或 0 刻度以下,记下读数;

F.把锥形瓶放在滴定管的下面,用标准 NaOH 溶液滴定至终点并记下滴定管液面的刻度。
(1)正确操作步骤的顺序是(用序号字母填写)B_______F ;
(2)滴定达到终点的现象_________。
(3)用标准 NaOH 溶液滴定时,应将标准 NaOH 溶液注入_____(右图“甲”或“乙”)中。
(4)滴定时边滴边摇动锥形瓶,眼睛应观察_______。
(5)据下列数据计算,待测盐酸溶液的浓度为 ____mol·L-1 (计算结果保留小数点后四位)
实验编号 | 待测盐酸体积(m L) | 滴定前 NaOH 溶液的体积读数(mL) | 滴定后 NaOH 溶液 的体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(6)下列操作会导致测定结果偏低的是____。
A.碱式滴定管未用标准 NaOH 溶液润洗就装标准液滴定
B.读取标准液读数时,滴前仰视,滴定到终点后俯视
C.滴定前碱式滴定管尖嘴处有气泡未排除,滴定后气泡消失
D.酸式滴定管没有用待测盐酸润洗,直接装入待测盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ga、As、Al、C的相关化合物在化工和医学领域有着广泛的应用。回答下列问题:
(1)写出基态Ga原子的核外电子排布式:_________,有_____个未成对电子。
(2)合金砷化镓在现代工业中被广泛应用,Ga、As电负性由大到小排序为______________。
(3)1个丙二烯分子中σ键总数为___个,C原子的杂化方式为______。分子中的大π键可以用符号пmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为п66),则丙二烯中的大π键应表示为____________。
(4)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:

①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0, 0, 0);B为(1/2,1/2,0);C为(1,0,1)。则D原子的坐标参数为_________________。
②已知氮化镓晶胞的边长为a nm,其密度为d g/cm3,则阿伏加德罗常数NA =____(用a、d表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)在Fe3O4+4CO ![]() 3Fe+4CO2的中,是还原剂,元素被还原,当有标状下的CO气体560ml完全反应时,生成Fe是克.
3Fe+4CO2的中,是还原剂,元素被还原,当有标状下的CO气体560ml完全反应时,生成Fe是克.
(2)下列物质能导电的是(用序号填空,下同)属于电解质的是 , 属于非电解质的是 .
①水银 ②烧碱 ③大理石 ④氯化钠晶体 ⑤盐酸
⑥氨气 ⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各方法中能对金属起到防止或减缓腐蚀作用的是( )
①金属表面涂抹油漆 ②改变金属的内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A.①②③④
B.①③④⑤
C.①②④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东正在打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________________。
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
b. ![]() △H2
△H2
已知H2(g)+ ![]() O2(g)
O2(g) ![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
则反应②的△H2=_________ kJ·mol-1。
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。
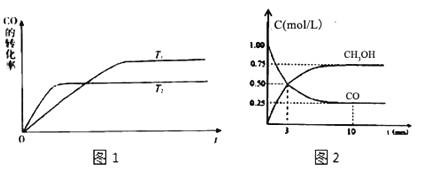
①该反应的焓变△H_____0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1_____K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=_____,该反应的平衡常数为K=_____。
④恒容条件下,达到平衡后,下列措施中能使![]() 增大的有_____。
增大的有_____。
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com