
| A.做银镜反应后的试管用氨水洗涤 |
| B.盛装醋酸的试剂瓶用酒精洗涤 |
| C.盛装苯酚后的试管用盐酸洗涤 |
| D.盛装油脂的试剂瓶用热的纯碱溶液洗涤 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:不详 题型:实验题
| A.用托盘天平称取4.00g干燥的NaOH固体,溶解于6ml蒸馏水中,配制10%NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液。 |
| B.实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水。 |
| C.钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中。 |
| D.煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④ | B.①③⑤⑦ | C.①④⑥⑧ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用托盘天平称取5.5 g KCl固体 |
| B.在酸碱中和滴定实验中,量取20. 00 mL待测NaOH溶液用20mL量筒 |
| C.将干燥的pH试纸浸入某溶液一会儿后取出,与标准比色卡比较以测定该溶液的pH |
| D.配制0.1 mol·L-1的硫酸溶液时,将量取的浓硫酸放入容量瓶中加水稀释 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作 | 现象 |
| A | 饱和食盐水中滴加少量浓盐酸,振荡 | 溶液变浑浊 |
| B | 饱和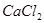 溶液中通入 溶液中通入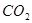 ,振荡 ,振荡 | 溶液变浑浊 |
| C | 澄清石灰水中通入足量的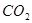 ,振荡 ,振荡 | 溶液变浑浊 |
| D | 氨水中滴加少量 溶液,振荡 溶液,振荡 | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.粗略配制浓度为2 mol·L—1的NaCl溶液,可将58.5gNaCl加入到盛有500mL水的烧杯中,搅拌、溶解 |
| B.将滴定管洗净,再用蒸馏水润洗后,即可注入标准液进行滴定 |
| C.向乙酸乙酯中加入稀NaOH溶液,振荡,分液,可除去乙酸乙酯中的少量乙酸 |
| D.为验证氯仿中含有的氯元素,可向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3,观察到白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 |
| B.用托盘天平称取NaOH固体时需先在左右两盘中各放上大小相同的纸片 |
| C.若25 mL滴定管中液面的位置在刻度为10mL处,则滴定管中液体的体积一定大15 mL |
| D.用玻璃棒蘸取溶液滴在表面皿上的已润湿pH试纸上测得其pH为12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
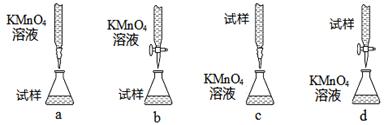
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com