
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )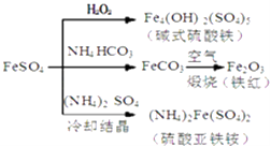
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
【答案】D
【解析】解:A.碱式硫酸铁电离产生Fe3+ , Fe3+ , 能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,故A正确;
B.NH4HCO3不稳定,受热易分解,所以为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,故B正确;
C.KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2若被氧化则生成Fe3+ , KSCN溶液遇Fe3+溶液变红,故C正确;
D.(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,所以FeSO4才能与(NH4)2SO4反应生成(NH4)2Fe(SO4)2 , 故D错误;
故选D.
A.根据Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂;
B.根据NH4HCO3不稳定,受热易分解;
C.KSCN溶液遇Fe2+溶液无现象,遇Fe3+溶液变红;
D.根据溶解度大的沉淀可以转化为溶解度小的沉淀.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10﹣10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | ﹣ | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | ﹣2 | ﹣ | ﹣2 | ﹣ | ﹣4 | ﹣3 | ﹣1 | ﹣ | ﹣3 | ﹣4 |
试回答下列问题:
(1)以上10种元素电负性最大的是(填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第周期,第族,其基态原子的核外电子排布式是 .
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序) .
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成个σ键,个π键.
(4)I与氢元素形成的10电子分子X的空间构型为;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为 , 其中X与Cu2+之间以键结合.
(5)如图1是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: a.
b.
(6)如图2是J和E组成的晶体结构,则每个与J周围最近J原子数目为 , 若晶胞边长为a cm,则晶体的密度为(用含a、NA的代数式表示)(g/mL) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中水只作还原剂的是( )
A.2H2O ![]() 2H2↑+O2
2H2↑+O2
B.2Na+2H2O═2NaOH+H2↑
C.Cl2+H2O═HCl+HClO
D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应:①H++OH- H2O;②2H2+O2 2H2O;③HCl+NH3 NH4Cl; ④BaCl2+(NH4)2SO4 BaSO4↓+2NH4Cl;⑤Fe+Cu2+ Cu+Fe2+;⑥NaNH2+H2O NaOH+NH3中,反应时不形成配位键的是( )
A.①②④⑤⑥
B.②④⑤⑥
C.②④⑤
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应 11P+15CuSO4+H2O=5Cu3P+6H3PO4中,还原产物和氧化产物分别是 和;当1mol CuSO4参与反应吋,其能氧化P的物质的量是 , 整个反应电子转移总数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.瓦斯中甲烷和氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为1:2
B.欲配制1.00 L1.00 molL﹣1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
C.22.4LN2和H2的混合气体中含NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 得到8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α﹣氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为(填选项编号).
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 .
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 .
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3 , 已知:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38 , 则该温度下反应Fe3++3H2OFe(OH)3+3H+的平衡常数为 .
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)212H2O] ![]() 2Al2O3+2NH3↑+N2↑+
2Al2O3+2NH3↑+N2↑+
5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置.
①集气瓶中收集到的气体是 (填化学式).
②KMnO4溶液褪色,发生的离子反应方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向一定体积的0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 ![]() 不变
不变
D.溶液中 ![]() 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com