
【题目】下列说法正确的是( )
A.瓦斯中甲烷和氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为1:2
B.欲配制1.00 L1.00 molL﹣1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
C.22.4LN2和H2的混合气体中含NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 得到8NA个电子
【答案】A,D
【解析】A.令甲烷与氧气的质量分别为1g、4g,则:甲烷的物质的量为 ![]() =
= ![]() mol,氧气的物质的量为:
mol,氧气的物质的量为: ![]() =
= ![]() mol,相同条件下,体积之比等于物质的量之比,故此时甲烷与氧气的体积比为
mol,相同条件下,体积之比等于物质的量之比,故此时甲烷与氧气的体积比为 ![]() mol:
mol: ![]() mol=1:2,故A符合题意;
mol=1:2,故A符合题意;
B.可将58.5 g NaCl溶于1.00 L水中,溶液体积大于1.00L,则物质的量浓度小于1.00 molL﹣1,故B不符合题意;
C.气体状况未知,Vm不确定,无法计算,故C不符合题意;
D.Fe3O4中铁为+ ![]() 价,故1mol铁反应失去
价,故1mol铁反应失去 ![]() mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故D符合题意;
mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故D符合题意;
所以答案是:AD.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图.请根据该示意图完成下列题目: 
(1)请问:甲池是装置,乙池是装置.
(2)在甲池中:通入C2H4的电极名称是 , 通入O2的电极的电极反应式是 . 甲池中发生的反应的化学方程式为 .
(3)在乙池中:B(石墨)电极的名称是 , A(Fe)电极的电极反应式为 .
(4)乙池中反应的化学方程式为 .
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13.0gZn 与 200mL 1.5molL﹣1 H2SO4溶液充分反应后,所得溶液中的溶质是(填化学式),其中阳离子的物质的量浓度为(忽略反应前后溶液体积变化).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )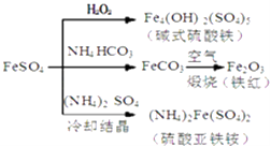
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬天使用的热敷袋里面有铁粉、氯化钠、碳粉,利用铁被氧化放出的热量取暖.某同学拆开一袋后取里面的固体粉末进行实验:
①将粉末投入盛有足量稀盐酸的烧杯中,观察到有大量气泡产生,底部有黑色粉末.则发生反应的离子方程式为 .
②为分离出反应后的溶液,可将上述烧杯中混合物进行操作,该操作需要的玻璃仪器为 .
③在②得到的溶液中通入氯气,发生如下离子反应:2Fe2++Cl2=2Fe3++2Cl-;在该离子方程式中,当有ag氧化产物生成时,需通入标准状况下的氯气体积为L(用含a的代数式表示).
④该同学将少量铜片投入制得的含FeCl3的溶液中,发现铜片慢慢溶解消失,溶液由黄色变为青绿色.则发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于NH3和CO2的说法中正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化
C.NH3为三角锥形结构,CO2为直线形结构
D.N原子和C原子上都没有孤对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含分子物质的量最多的是( )
A. 56 g N2 B. 标准状况下3.36 L O2
C. 6 g H2 D. 3.01×1023个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用来证明非金属性Cl>I的事实是( )
A. ICl中I是+1价,Cl是-1价B. 稳定性:HCl>HI
C. 酸性:HCl<HID. Fe3+可以氧化I-,但不能氧化Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com