
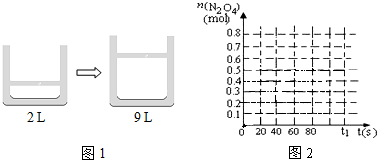
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 2.00 | n1 | 1.25 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.20 | n2 | 0.50 | 0.50 |
| c(N2O4) |
| c2(NO2) |
 N2O4 为放热反应,据此答题;
N2O4 为放热反应,据此答题;
| ||
| 20s |
 N2O4
N2O4 | c(N2O4) |
| c2(NO2) |
| 0.25 |
| 0.52 |
 ?N2O4 为放热反应,故△H<0,故答案为:<;
?N2O4 为放热反应,故△H<0,故答案为:<; N2O4
N2O4 | 2 |
| 9 |
| 2x |
| 9 |
| x |
| 9 |
| 2 |
| 9 |
| 2x |
| 9 |
| x |
| 9 |
| c(N2O4) |
| c2(NO2) |
| ||||
(
|
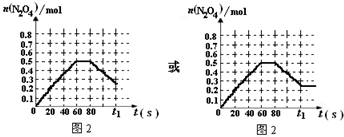 ,
, .
.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、给试管里的固体加热时,试管口略向下倾斜 |
| B、给烧瓶里的液体加热时,垫上石棉网 |
| C、用燃着的酒精灯去点燃另一个酒精灯 |
| D、用托盘天平称量固体的质量时,砝码放在右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(C6H12O7)2Ca |
| B、(C6H11O7)2Ca |
| C、(C6H12O6)2Ca |
| D、(C6H12O8)2Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
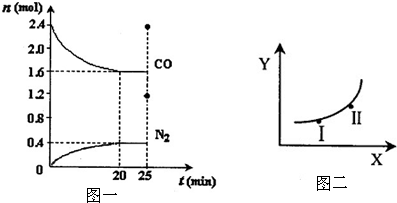
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl、I2 |
| B、NaCl、NaBr |
| C、NaBr、I2 |
| D、NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com