
(10分)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:

实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验二放出氢气量减少的原因是 。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:阅读理解
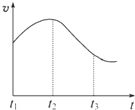 (思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
(思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验二放出氢气量减少的原因是 。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(四)化学试卷(B卷)(带解析) 题型:实验题
[2012·漳州质检](11分)某研究学习小组为探究Fe3+离子是否能氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
(1)甲同学利用以上实线框内装置制取SO2并进行探究实验。
①装置A中发生反应的化学方程式为 。
②装置B的作用是 。
③反应一段时间后,甲同学取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液观察到有白色沉淀产生。由此他得出结论:Fe3+可氧化SO2。
(2)乙同学认为甲同学的实验不严谨,他用以上虚线框内装置替代装置A,先使装置E内试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中少量溶液,往其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此他得出结论:Fe3+已被SO2还原成Fe2+。
①该实验制H2时需用浓硫酸配制450mL3mol/L的稀硫酸,配制中所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需 。
配制过程中若其它操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会 (填“偏高”、“偏低”或“无影响”)。
②在该实验过程中H2所起得作用是 。
(3)丙同学认为甲、乙的实验均不严谨,为此他沿用乙同学的实验装置及操作,重新实验。待装置F内反应一段时间后,取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液,得出与甲同学相同的结论。请你分析回答:
①甲同学实验不严谨的原因是 。(选填序号)
| A.SO2溶解量太小 |
| B.SO2不与Fe3+发生反应 |
| C.H2SO3与BaCl2不反应 |
| D.装置中的空气与SO2进入水中也可生成H2SO4 |
查看答案和解析>>
科目:高中化学 来源:2010年陕西省西安铁一中高一第二学期期中考试化学试题 题型:填空题
(10分)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验: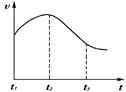
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验二放出氢气量减少的原因是 。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com