
【题目】在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.Cu2+、H+、Cl- B.CO32-、OH-、Cl-
C.K+、H+、Cl- D.K+、OH-、CO32-
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】
铁和铜都是生产、生活中应用广泛的金属,能形成很多种合金和化合物。请回答:
(1)基态Cu+的价层电子排布图为________。基态Fe3+中有________种运动状态不同的电子。
(2)铁单质能形成Fe(CO)5,其熔点为-21℃,沸点为102.8℃。则Fe(CO)5晶体的类型为________,其σ键和π键的数目之比为________。与CO互为等电子体的离子符号为________(任写一种)。
(3)铜元素的焰色反应呈绿色,很多金属元素能发生焰色反应的微观原因为________。
(4)[Cu(NH3)4]SO4中,所含基态非金属原子的第一电离能由小到大的顺序为________。阴离子的空间构型为________,其中心原子的杂化轨道类型为________。
(5)铁单质的一种晶体的堆积模型为体心立方堆积,晶胞参数为apm;铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm。则两种晶体中,铁原子和铜原子的配位数之比为________,晶体的密度之比为________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图:
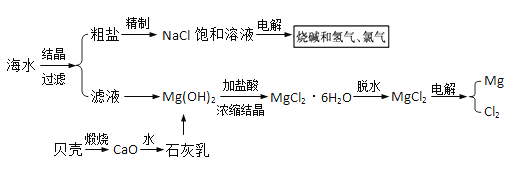
试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是:____,还需要的玻璃仪器有:____。
(2)粗盐中含有Ca2+、 Mg2+、 SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2C03溶液,则添加试剂顺序为____(填写序号),最后在滤液加入盐酸至溶液呈中性。请写出加入盐酸后可能发生反应的离子方程式:____。
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式:____。
(4)电解无水氯化镁制取镁的化学方程式为____。将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 molL-1的NaOH溶液分别滴定体积均为20mL、浓度均为0.1 molL-1的HC1溶液和HX溶液,溶液的pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
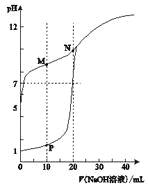
A. M点对应溶液中:c(HX)<c(X-)
B. HX的电离平衡常数Ka约为1×10-5
C. P点对应溶液中 c(Cl-) ="0.05" mol L-1
D. N点对应溶液pH>7的原因是X-+ H2O![]() HX+OH-
HX+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来”诗人在远处能闻到梅花香味,表明
A. 分子很小 B. 分子可再分
C. 分子之间有间隙 D. 分子在不停地运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】魔术师将半杯“白酒”倒入半杯“黄酒”中变成了一杯“红酒”,“白酒”和“黄酒”的成分可能是
“白酒” | “黄酒” | |
A | KSCN溶液 | FeCl3溶液 |
B | KOH溶液 | 溴水 |
C | KOH溶液 | 酚酞溶液 |
D | 淀粉溶液 | 碘水 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R′CH2Cl![]() RNHCH2R′+HCl(R和R′代表烃基)
RNHCH2R′+HCl(R和R′代表烃基)
②苯的同系物能被高锰酸钾氧化,如: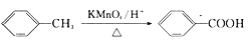
③
化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
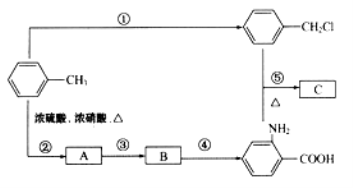
(1)B物质的结构简式是_____________.
(2)写出反应①、②的化学方程式:
①_____________________
②_____________________
(3)反应①~⑤中,属于取代反应的是_____________(填反应序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.含有离子键的化合物一定是离子化合物
B.非金属之间形成的化学键不一定是共价键
C.含有共价键的化合物不一定是共价化合物
D.在共价化合物中也可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用如图所示装置进行实验。
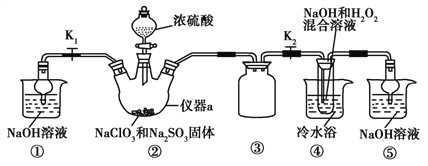
(1)仪器a的名称为____,装置①的作用是____,装置③的作用是______。
(2)装置②中产生ClO2,涉及反应的化学方程式为________________;装置④中反应生成NaClO2的化学方程式为_______________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,_____________________。
(5)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度_____。(提示:2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com