
【题目】
铁和铜都是生产、生活中应用广泛的金属,能形成很多种合金和化合物。请回答:
(1)基态Cu+的价层电子排布图为________。基态Fe3+中有________种运动状态不同的电子。
(2)铁单质能形成Fe(CO)5,其熔点为-21℃,沸点为102.8℃。则Fe(CO)5晶体的类型为________,其σ键和π键的数目之比为________。与CO互为等电子体的离子符号为________(任写一种)。
(3)铜元素的焰色反应呈绿色,很多金属元素能发生焰色反应的微观原因为________。
(4)[Cu(NH3)4]SO4中,所含基态非金属原子的第一电离能由小到大的顺序为________。阴离子的空间构型为________,其中心原子的杂化轨道类型为________。
(5)铁单质的一种晶体的堆积模型为体心立方堆积,晶胞参数为apm;铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm。则两种晶体中,铁原子和铜原子的配位数之比为________,晶体的密度之比为________(用代数式表示)。
【答案】 ![]() 23 分子晶体 3︰1 CN-(或
23 分子晶体 3︰1 CN-(或![]() 等合理答案即可得分) 电子由较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,形成焰色反应 H<S<O<N 正四面体形 sp3 2︰3
等合理答案即可得分) 电子由较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,形成焰色反应 H<S<O<N 正四面体形 sp3 2︰3 ![]()
【解析】试题分析:(1)29号铜元素核外有29个电子,基态Cu+,核外电子数为28,3d轨道的电子为价电子;26号铁元素,Fe3+核外有23个电子,所有电子的运动状态都不同。(2)分子晶体熔沸点较低;CO分子中含有碳氧三键;原子数相同、电子总数相同的分子或离子,互称为等电子体;(3)电子由较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,形成焰色反应;(4)同一周期元素从左到右第一电离能逐渐增大,但第VA族元素最外层半充满,为温度结构,所有第一电离能大于属于第VIA族元素,同一周期从上到下第一电离能减小;SO42-价电子对数为![]() ,轨道杂化方式为SP3,无孤对电子;(5) 体心立方堆积配位数是8,面心面心立方最密堆积,配位数是12;晶胞的边长为apm,1mol晶胞体积为(a×10-10cm)3 NA,晶胞中有2个Fe原子,故1mol晶胞质量为2×56NA g,铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm,1mol晶胞体积为(b×10-10cm)3 NA,晶胞中有4个铜原子,1mol晶胞质量4×64NAg。
,轨道杂化方式为SP3,无孤对电子;(5) 体心立方堆积配位数是8,面心面心立方最密堆积,配位数是12;晶胞的边长为apm,1mol晶胞体积为(a×10-10cm)3 NA,晶胞中有2个Fe原子,故1mol晶胞质量为2×56NA g,铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm,1mol晶胞体积为(b×10-10cm)3 NA,晶胞中有4个铜原子,1mol晶胞质量4×64NAg。
解析:(1)基态Cu+,核外电子数为28,价层电子排布图为![]() ;Fe3+核外有23个电子,有23种运动状态不同的电子;(2)根据Fe(CO)5晶体的熔沸点较低,判断晶体类型为分子晶体,单键为σ键,三键中1个σ键和2个π键,其σ键和π键的数目之比为3︰1。CO有14个电子, 与CO互为等电子体的离子符号为CN-或
;Fe3+核外有23个电子,有23种运动状态不同的电子;(2)根据Fe(CO)5晶体的熔沸点较低,判断晶体类型为分子晶体,单键为σ键,三键中1个σ键和2个π键,其σ键和π键的数目之比为3︰1。CO有14个电子, 与CO互为等电子体的离子符号为CN-或![]() ;(3)电子由较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,形成焰色反应, 所有很多金属元素能发生焰色反应;N、O元素属于同一周期且N元素属于第VA族,O元素属于第VIA族,第一电离能O<N ,O、S属于同一周期且S元素的原子序数大于O元素,所以第一电离能O>S,大小顺序是N>O>S,所有第一电离能H<S<O<N;SO42-价电子对数为
;(3)电子由较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,形成焰色反应, 所有很多金属元素能发生焰色反应;N、O元素属于同一周期且N元素属于第VA族,O元素属于第VIA族,第一电离能O<N ,O、S属于同一周期且S元素的原子序数大于O元素,所以第一电离能O>S,大小顺序是N>O>S,所有第一电离能H<S<O<N;SO42-价电子对数为![]() ,轨道杂化方式为SP3,空间构型为正四面体形; (5)体心立方堆积配位数是8,面心面心立方最密堆积,配位数是12,配位数之比为2:3;晶胞的边长为apm,1mol晶胞体积为(a×10-10cm)3 NA,晶胞中有2个Fe原子,故1mol晶胞质量为2×56NA g,铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm,1mol晶胞体积为(b×10-10cm)3 NA,晶胞含有4个铜原子,1mol晶胞质量4×64NAg,铁的密度比为2×56NAg÷(a×10-10cm)3 NA、铜的密度为4×64NAg÷(b×10-10cm)3 NA,密度比为
,轨道杂化方式为SP3,空间构型为正四面体形; (5)体心立方堆积配位数是8,面心面心立方最密堆积,配位数是12,配位数之比为2:3;晶胞的边长为apm,1mol晶胞体积为(a×10-10cm)3 NA,晶胞中有2个Fe原子,故1mol晶胞质量为2×56NA g,铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm,1mol晶胞体积为(b×10-10cm)3 NA,晶胞含有4个铜原子,1mol晶胞质量4×64NAg,铁的密度比为2×56NAg÷(a×10-10cm)3 NA、铜的密度为4×64NAg÷(b×10-10cm)3 NA,密度比为![]() 。
。


科目:高中化学 来源: 题型:
【题目】分离提纯是化工生产中常用的方法。下列说法合理的是
A. 蒸馏自来水可得到蒸馏水 B. 酸溶法除去Al2O3的Fe2O3
C. 过滤法除去乙酸中的乙醇 D. 碱溶法除去Al2O3中的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偶氮苯是橙红色晶体,溶于乙醇,微溶于水,广泛应用于染料制造和橡胶工业,以硝基苯、镁粉和甲醇为原料制备偶氮苯的实验步骤如下:
步骤1:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。
步骤2:等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤3:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤4:用95%的乙醇重结晶。
(1)步骤1中反应不需要加热就能剧烈进行,原因是________________。镁粉分两次加入而不是一次性全部加入的原因是___________________ _____________________________________________________。
(2)步骤3中析出固体用冰水洗涤的原因是________________。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管(应接管)和锥形瓶外还应有________________________________________________________________。
(3)取0.1 g偶氮苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1 cm处,再将滤纸条末端浸入装有1∶3的苯环己烷溶液的容器中,实验操作及现象如下图所示:
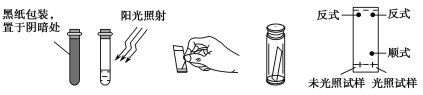
①实验中分离物质所采用的方法是________法。
②由实验结果可知:________________;利用该方法可以提纯反式偶氮苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。常温下A、C、D是常见气体,A是导致“温室效应”的主要物质,B是常见无色液体,C能使湿润的红色石蕊试纸变蓝,F是白色沉淀,G是红褐色沉淀。X加热生成A、B、C的物质的量之比为1︰1︰1。

请回答下列问题:
⑴C的电子式为 。
⑵X的化学式为 。
⑶写出反应①的离子方程式: 。
⑷写出反应②的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A.碱性氧化物:Na2O、CaO、Mn2O7、Na2O2
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D.氧化物:CO2、NO、SO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与应用对应关系不正确的是
A. 二氧化氯具有强氧化性,可用于杀菌消毒
B. 氢氧化铝具有弱碱性,可用于治疗胃酸过多
C. 二氧化硅的熔沸点很高,可用于制作石英坩埚
D. 钠钾合金的密度小,可用于快中子反应堆的热交换剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列实验方法操作,能达到要求的是
A. 用托盘天平称量25.20g氯化钠固体
B. 实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片防止暴沸
C. 加热饱和FeCl2溶液制备Fe(OH)3胶体
D. 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.Cu2+、H+、Cl- B.CO32-、OH-、Cl-
C.K+、H+、Cl- D.K+、OH-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com