
【题目】光导纤维的主要成分是( )
A.Si
B.SiO2
C.SiC
D.Na2SiO3
科目:高中化学 来源: 题型:
【题目】I.某学生利用下图装置测定反应过程中所放出的热量并计算中和热。所用药品为50ml 0.50mol·L-1盐酸与50ml 0.55mol·L-1NaOH溶液。请回答下列问题:
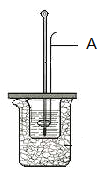
(1)图中A仪器名称为__________。其作用为__________。
(2)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是____________。
A.测量盐酸的温度后,温度计没有用水冲洗干净,立即去测量氢氧化钠溶液的温度
B.把量筒中的氢氧化钠溶液一次性快速倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
II.(1)原电池是将化学能转化为电能的装置,现将下列化学反应设计成带盐桥原电池,请你画出该原电池装置简图(标明电极材料名称和试剂名称):Zn+CuSO4= ZnSO4+Cu_________
(2)盐桥中的阴离子向_________(填正极或负极)迁移。
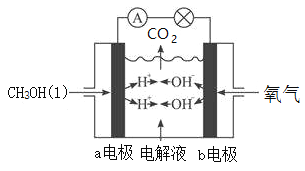
III.下图为甲醇(CH3OH)燃料电池装置,该装置能量转化率可达90%,当通入67.2L(标况下)氧气时,产生1306kJ电能,则甲醇液体的燃烧热的热化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3·H2O的电离平衡常数Kb=1.75×10-5。该温度下,用0.01mol·L-1盐酸滴定10mLamol·L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示。下列说法正确的是
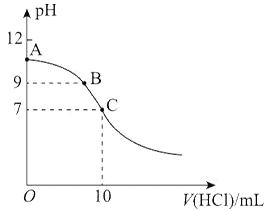
A. A点溶液中加少量水,![]() 减小
减小
B. 原氨水的物质的量浓度约为1.006×10-2mol·L-1
C. A、B、C三点溶液中水电离出来的c(OH-):A>B>C
D. C点时,盐酸和氨水恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁和铜都是生产、生活中应用广泛的金属,能形成很多种合金和化合物。请回答:
(1)基态Cu+的价层电子排布图为________。基态Fe3+中有________种运动状态不同的电子。
(2)铁单质能形成Fe(CO)5,其熔点为-21℃,沸点为102.8℃。则Fe(CO)5晶体的类型为________,其σ键和π键的数目之比为________。与CO互为等电子体的离子符号为________(任写一种)。
(3)铜元素的焰色反应呈绿色,很多金属元素能发生焰色反应的微观原因为________。
(4)[Cu(NH3)4]SO4中,所含基态非金属原子的第一电离能由小到大的顺序为________。阴离子的空间构型为________,其中心原子的杂化轨道类型为________。
(5)铁单质的一种晶体的堆积模型为体心立方堆积,晶胞参数为apm;铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm。则两种晶体中,铁原子和铜原子的配位数之比为________,晶体的密度之比为________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明溶液中,下列离子一定能共存的是( )
A.H+ Cu2+ Cl﹣ SO42﹣
B.HCO3﹣ NO3﹣ Na+ H+
C.SO42﹣ Cl﹣Na+ K+
D.Na+SO42﹣H+ AlO2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是

A. Y、Z、W处于同一周期
B. X、Y、Z、W的原子序数递增
C. X、W可形成化学式为XW的离子化合物
D. 简单离子半径是Z小于W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来”诗人在远处能闻到梅花香味,表明
A. 分子很小 B. 分子可再分
C. 分子之间有间隙 D. 分子在不停地运动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com