
【题目】已知某炔烃与卤素单质按物质的量为1: 2发生加成反应,反应后,生成的有机物至少需6mol的卤素单质才能把生成的有机物中的氢全部取代,则该炔烃可能是
A. 丙炔 B. 1-丁炔 C. 3-己炔 D. 2-庚炔
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是( )
A. 构造原理 B. 泡利原理 C. 洪特规则 D. 能量最低原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量: 。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量: 。
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量: 。
⑷已知下列反应的反应热为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+![]() O2(g)=H2O(l) △H3=-285.8kJ/mol
O2(g)=H2O(l) △H3=-285.8kJ/mol
试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(已知:2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6KJ·mol-1),恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )
2SO3(g)△H=-196.6KJ·mol-1),恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )

A.表示硫的燃烧热的热化学方程式:S(s)+O2(g)==SO2(g)ΔH=-297KJ·mol-1
B.由Ⅱ到Ⅲ的过程放出的热量为98.3KJ
C.恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值大于78.64KJ
D.将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A. 制取溴苯:将铁屑、溴水、苯混合加热
B. 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
C. 除去乙醇中少量的乙酸:加入足量生石灰,蒸馏
D. 检验卤代烃中的卤原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸的叙述,错误的是( )
A.硅酸是一种很弱的酸
B.硅酸可由二氧化硅与水反应制得
C.硅酸不稳定,加热脱水会生成二氧化硅
D.硅酸可以由可溶性硅酸盐与盐酸反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A﹣R 9种元素在周期表中的位置

(1)这 9种元素中化学性质最不活泼的是________(以上均填元素符号)
(2)B、C、D三种元素按原子半径由大到小的顺序排列为________(用元素符号表示)
(3)F元素简单氢化物的化学式是________,H元素跟B元素形成化合物的化学式是______,高温灼烧该化合物时,火焰呈________色.
(4)G元素和 H元素两者核电荷数之差是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PC 是一种可降解的聚碳酸酯类高分子材料,具有广泛应用,其结构简式为:
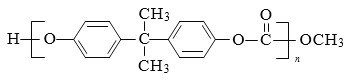 。一种生产 PC 的合成路线如下:
。一种生产 PC 的合成路线如下:
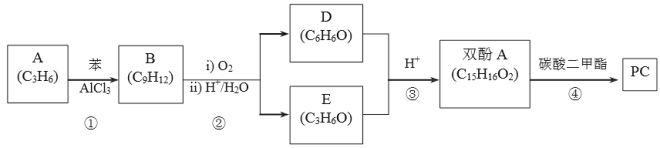
其中,A 可使 Br2 的 CCl4 溶液褪色,B 中有五种不同化学环境的氢,D 可与 FeCl3 溶液发生显色反应;E 可与 H2 发生加成反应,其核磁共振氢谱为单峰。
已知: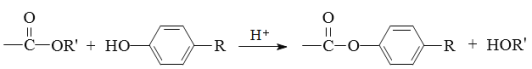
请回答下列问题:
(1)D 中官能能团名称 ,A 的结构简式是 ,A 与 Cl2 反应的产物名称是 ,B 的结构简式是 。
(2)第③步反应的化学方程式是 。
(3)碳酸二甲酯的一种同分异构体名叫乳酸,该物质能发生的化学反应有 (填字母)。
a. 取代反应 b. 加成反应 c. 消去反应 d. 加聚反应
(4)碳酸二甲酯有多种同分异构体,写出其中能与 Na2CO3 溶液反应的任意一种同分异构体结构简式 (乳酸除外)
(5)第④步反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是 。完成酸浸过程中反应的离子方程式:
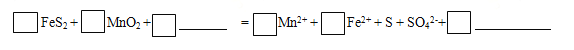
(2) 加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理: 。(结合离子方程式解释)
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是
极(填“a”或“b”),生成EMD的电极反应式是 。
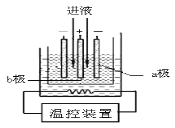
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是 (填字母序号)。[来源
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com