


科目:高中化学 来源: 题型:
| A、pH=1溶液中:K+、Mg2+、AlO2-、S2O32- | ||
| B、Na2S溶液中:SO42-、K+、Cl-、Cu2+ | ||
C、
| ||
| D、含Fe2+溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
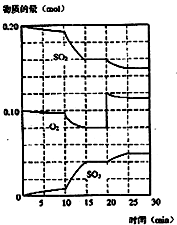 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
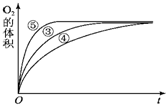 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,有机物A的键线式结构为
,有机物A的键线式结构为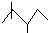 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.则:
,有机物B与等物质的量的H2发生加成反应可得到有机物A.则:查看答案和解析>>
科目:高中化学 来源: 题型:
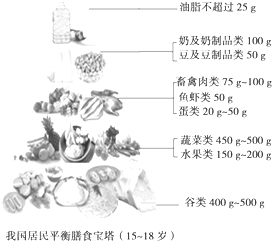 《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.
《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 |
| B、H2(g)+F2(g)=2HF(g)△H=-270 kJ/mol,1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
| C、相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+O2是一个吸热反应 |
| D、破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,则Q1+Q2<2Q3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com