

 ����B����
����B���� =
= �������¶�T1���䣬8���Ӻ��������������������ĩ������0.75mol/L��CO�����ʱc��CO��=1.75mol/L��c��CO2��=0.5mol/L����COת����x����
�������¶�T1���䣬8���Ӻ��������������������ĩ������0.75mol/L��CO�����ʱc��CO��=1.75mol/L��c��CO2��=0.5mol/L����COת����x���� =
= ��x=0.25����CO��ת����Ϊ
��x=0.25����CO��ת����Ϊ ×100%=33.3%����D��ȷ��
×100%=33.3%����D��ȷ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ�ȣ�mol?L-1�� | 0.40 | 0.6 | 0.6 |
| c(CH3OCH3)c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| c2(CH3OH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
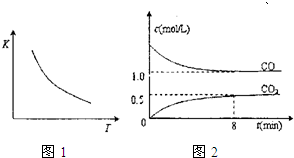 ��2010?������ģ��һ��������ij�ܱ������з�����Ӧ��FeO��s��+CO��g��?Fe��s��+CO2��g������֪�÷�Ӧ��ƽ�ⳣ����K�������¶ȣ�T���Ĺ�ϵ��ͼ1��ͼ2��T1�¶��¸÷�Ӧ��c-t��ϵͼ��������˵����ȷ���ǣ�������
��2010?������ģ��һ��������ij�ܱ������з�����Ӧ��FeO��s��+CO��g��?Fe��s��+CO2��g������֪�÷�Ӧ��ƽ�ⳣ����K�������¶ȣ�T���Ĺ�ϵ��ͼ1��ͼ2��T1�¶��¸÷�Ӧ��c-t��ϵͼ��������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и�����ѧ����ĩ������⻯ѧ�Ծ���A�����������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������������һ����ȷ����
A��һ��������ij�ܱ�����ʢ��0.1 mol N2��0.3 mol H2����ַ�Ӧ��ת�Ƶ�����Ϊ0.6NA
B��50mL18.4 mol��L-1Ũ����������ͭ���ȷ�Ӧ������SO2�ķ�����Ϊ0.46NA
C��һ��������4.6g Na��ȫ��O2��Ӧ����7.2 g���ʧȥ�ĵ�����Ϊ0.2NA
D�����1L NaCl��Һ��c(OH-) = 0.2 mol��L -1��ת�Ƶ�����Ϊ0.4NA���������������Һ������䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��������ģ ���ͣ���ѡ��
| A�����������������䣬����ѹǿ��ѹ�����������ѧ��Ӧ���ʲ��� |
| B�����������������䣬�����¶ȣ�c��CO2��/c��CO����С |
| C�������¶Ⱥ�������䣬���������ܶȲ��䲻����Ϊ�˻�ѧƽ��״̬�ı�־ |
| D�������¶�T1���䣬8���Ӻ��������������������ĩ������0.75mol/L��CO��ƽ��ʱCO��ת����Ϊ33.3% |
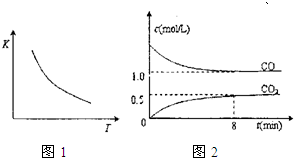
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com