
【题目】研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)→2H2(g)+2CO(g)。
(1)该反应的平衡常数K=__。在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,则v(CH4)__。
(2)根据如图可得出n(CO2)消耗__n(CH4)消耗(填“>”、“<”和“=”,原因是___。

【答案】 0.005mol/(L·min) > 有水生成,平衡时n(H2)<n(CO),说明部分CO2和H2发生了反应
0.005mol/(L·min) > 有水生成,平衡时n(H2)<n(CO),说明部分CO2和H2发生了反应
【解析】
(1)平衡常数K=生成物浓度的幂之积/反应物浓度的幂之积;据此写出该反应的平衡常数K的表达式;根据30min后CH4的质量的变化量,求出变化的浓度,根据v(CH4)=c/t进行计算;
(2)根据图中信息,有水生成,平衡时n(H2)<n(CO),所以反应中二氧化碳的消耗量大于甲烷的消耗量,说明部分CO2和H2发生了反应。
(1)已知CH4(g)+CO2(g)=2H2(g)+2CO(g),根据平衡常数的定义可知,该反应的平衡常数K= ;在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,减小的甲烷的物质的量为4.8g/16g/mol=0.3mol,浓度的变化为0.3mol/2L=0.15mol/L;则v(CH4)=c/t=0.15mol/L/30min=0.005mol/(L·min);
;在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,减小的甲烷的物质的量为4.8g/16g/mol=0.3mol,浓度的变化为0.3mol/2L=0.15mol/L;则v(CH4)=c/t=0.15mol/L/30min=0.005mol/(L·min);
故答案是: ;0.005mol/(L·min) ;
;0.005mol/(L·min) ;
(2)根据图中信息,有水生成,平衡时n(H2)<n(CO),所以反应中二氧化碳的消耗量大于甲烷的消耗量, 即n(CO2)消耗大于n(CH4)消耗;说明部分CO2和H2发生了反应;
故答案是:> ;有水生成,平衡时n(H2)<n(CO),说明部分CO2和H2发生了反应。


科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
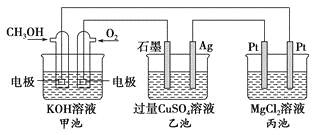
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人民网报道,浙江温岭一河流氨氮超标五倍,河水黑如墨水。氮氧化物污染日益严重,请分析下列有关NO、NO2等的试题,然后填空。
(1)下图所示为N2(g)和O2(g)生成NO(g)过程中的能量变化。
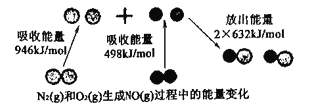
由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式____________
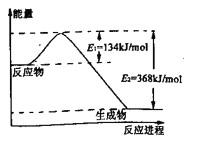
(2)下图是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________.
(3)已知:在298K、101kPa下,由稳定的单质生成1mol化合物的反应热叫做该化合物的生成热。如图为氧族元素(除钋外)的氢化物a、b、c、d的生成热数据示意图
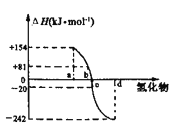
①请归纳:非金属元素的气态氢化物的稳定性与氢化物的生成热(ΔH)之间的关系______________________________
②写出硒化氢在298K、101kPa时发生分解反应的热化学反应方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常温钠离子全固态浓差电池工作示意图。正极材料为层状含钠过渡金属氧化物,负极为钠锡合金(Na15Sn4)。下列说法合理的是( )。
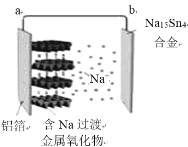
A.该电池工作时不发生氧化还原反应B.放电时,负极的反应为:Na15Sn4-15e-=15Na++4Sn
C.充电时,Na+会被吸附进入过渡金属氧化层D.充电时,a极接电源的负极,b极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应L(s)+aG(g) ![]() bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
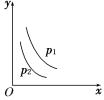
A. 上述反应是放热反应 B. 上述反应是吸热反应
C. a>b D. a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将NaBO2SiO2和Na的固体混合物与H2在500℃条件下制备NaBH4,实验装置如图所示已知NaBH4中B为+3价,下列说法错误的是

A.装置甲还可以用于制取CO2H2S
B.装置乙丙中分别装有NaOH溶液和浓硫酸
C.管式炉加热之前应收集装置尾部气体并验纯
D.可将反应后混合物加水溶解后用重结晶法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com