
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4L三氯甲烷中共价键数目为4NA
B.1mol碳烯(:CH2)所含电子总数为10NA
C.6.4gCaC2晶体中含有阴阳离子总数为0.2NA
D.1 mol CO2与含2 mol NaOH的溶液反应后,溶液中CO32-数为NA
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:2016届安徽省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列关于钠的叙述正确的是
A.将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液
B.金属钠与水的反应实质上是与水电离产生的H+反应
C.将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中。
D.做有关钠的性质实验时,剩余的Na不用放回原试剂瓶
查看答案和解析>>
科目:高中化学 来源:2016届福建省四地六校高三上学期第一次联考化学试卷(解析版) 题型:填空题
(11分)铬是水体的主要的污染物之一,可以导致水生生物死亡。化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质。例如处理铬的实验循环示意图如下:

(1)在上图所示的编号步骤中,其中反应①所用的试剂是硫酸酸化的H2O2,请写出该反应的离子方程式 。
(2)现有含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸,可将这两种离子相互分离,根据上图信息分析,在涉及的过滤操作中,上述两种离子的存在形态分别是__________、 。 (写化学式)
(3)铬的化合价除了示意图中涉及的+3和+6外,还有0、+2、+4和+5等。
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应。已知Na2SO4被Na2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 。
(4)步骤⑤应该加入________剂(填“还原”或“氧化”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下图表示反应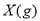
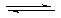
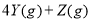 ,
,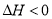 ,在某温度时
,在某温度时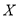 的浓度随时间变化的曲线:
的浓度随时间变化的曲线:
下列有关该反应的描述正确的是
A.第6 后,反应就终止了
后,反应就终止了
B. 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度,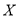 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减少
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省西安市高一上10月月考化学试卷(解析版) 题型:选择题
除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤,其错误的操作顺序为①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.⑤②④①③ B.⑤④②①③ C.④②⑤①③ D.②⑤④①③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:选择题
25℃时体积为1L浓度为0.15mol·L-1的NaOH溶液充分吸收2.24LCO2(标准状况),温度恢复到25℃。下列有关上述反应后溶液的说法及关系正确的是
A.反应过程中CO2过量,溶液的pH<7
B.水的离子积常数Kw<10-14
C.2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一上期中考试化学试卷(解析版) 题型:填空题
(10分)某化学课外活动小组用海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层溶液;
G.将分液漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗口上的小孔;
H.静置、分层。
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
________→________→________→A→________→G→E→F。
(2)上述E步骤中下层液体为___________色的__________溶液,E步骤操作中应注意:_________________________________。
(3)上述G步骤的操作的目的是:________________________。
(4)能用CCl4从碘水中萃取碘的原因是:_______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一上第一次月考化学试卷(解析版) 题型:选择题
在无色溶液中能大量共存的一组离子是
A.Ag+、Cl-、NO3-、K+ B.K+、Cu2+、SO42-、NO3-
C.K+、Mg2+、Cl-、OH- D.NH4+、SO 42-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二上学期期中测试化学试卷(解析版) 题型:填空题
(1)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:2NO2(g)?N2O4(g)当活塞迅速向里推时,气体的颜色先 ,后 (填“变深”“变浅”或“不变”前同);最终和最初相比,颜色 更深(填“最初”或“最终”下同),气体的平均相对分子质量 更大.
(2)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
①x= ,②B的转化率为 .
③温度降低,K值增大,则正反应是 (填“放热”或“吸热”)反应.
④能判断该反应达到平衡状态的依据是 (填编号)
A、混合气体的密度不变
B、容器中的压强不再变化
C、生成D的反应速率是生成B的反应速率的2倍
D、单位时间内生成3molA,同时生成1molB
⑤在其他条件不变的情况下,将原容器体积扩大到4L,下列有关该体系的说法正确的是( )(填编号)
A、B的浓度减少
B、正反应速率加快,逆反应速率也加快
C、C的物质的量增加
D、重新平衡时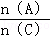 增大.
增大.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com