
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得: 
下列有关说法正确的是( )
A.苯酚和羟基扁桃酸互为同系物
B.羟基扁桃酸分子中至少有12个原子共平面
C.乙醛酸在核磁共振氢谱中只有1个吸收峰
D.常温下,1 mol羟基扁桃酸只能与1 mol Br2反应
【答案】B
【解析】解:A.因官能团不同,二者不能互为同系物,故A错误;B.与苯环相连的﹣OH上的O原子、苯环及苯环直接相连的C原子一定在同一平面内,则至少有1+6+4+1=12个原子共平面,故B正确;
C.乙醛酸中有2种位置不同的H原子,乙醛酸的核磁共振氢谱中有2个吸收峰,故C错误;
D.羟基扁桃酸中含有﹣OH、﹣COOH,只有苯酚结构的邻位与溴发生取代反应,则1mol羟基扁桃酸只能与2molBr2反应,故D错误.
故选B.
【考点精析】本题主要考查了有机物的结构和性质的相关知识点,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能正确解答此题.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4molL﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因__________
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是_________________。
(3)某小组同学用如图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.氢氧根离子的电子式是 ![]()
B.二氧化碳分子的比例模型是 ![]()
C.芳香烃的组成通式是CnH2n﹣6(n≥6)
D.12C和14C的原子结构示意图均可表示为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证铜与稀硝酸反应的还原产物是NO而不是NO2 . 某同学设计了如图所示的装置,下列叙述错误的是( ) 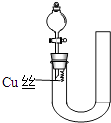
A.应先打开活塞和旋塞再从U型管右侧加入稀硝酸
B.加入的稀硝酸应充满U型管左侧
C.关闭旋塞后铜丝会全部溶解
D.反应停止后打开活塞,气体变成红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为Mg/mol.若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为 .
(2)该气体在标准状况下的体积为
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
(4)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )

A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较不正确的是 ( )
A. 锂与水反应不如钠与水反应剧烈
B. 碱金属Li、Na、K单质都能在O2中燃烧生成过氧化物
C. 熔、沸点:Li>Na>K
D. 碱性:LiOH<NaOH<KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义.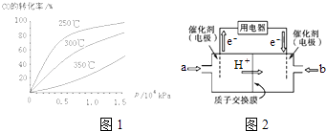
(1)NO2可用水吸收,相应的化学方程式为 . 利用反应6NO2+8NH3 ![]() 7N2+12H2O也可以处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
7N2+12H2O也可以处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
(2)已知:
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
2NO (g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)SO3(g)+NO (g) 的△H=kJmol﹣1 , 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K= .
(3)CO可用于合成甲醇,反应方程式为CO (g)+2H2(g)CH3OH (g).
①CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 .
②甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的极(填“正”或“负”),其电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com