
【题目】将Na2CO3和NaHCO3的混合物5.48g加热到质量不再减轻时,测得残留固体4.24g。另取一定质量的此混合物固体,跟 100 mL某浓度的盐酸刚好完全反应,并收集到 672 mL CO2气体(标准状况下),求;
(l)此混合物中NaHCO3的质量分数____;
(2)所用盐酸的物质的量浓度____。
【答案】61.3%0.4mol·L-1
【解析】
(1)固体加热时发生2NaHCO3==Na2CO3+CO2↑+H2O反应,利用差量法可计算原混合物中NaHCO3质量,进而计算碳酸氢钠的质量分数。
(2) Na2CO3和NaHCO3的混合物逐滴加盐酸过程中,碳酸钠先与盐酸发生Na2CO3+HCl== NaCl+NaHCO3反应,可以计算出盐酸的消耗量;然后发生NaHCO3+HCl==NaCl+CO2↑+H2O反应,根据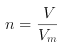 计算反应生成的二氧化碳的物质的量,结合反应方程式计算出消耗盐酸的量,计算出两个反应消耗盐酸的总量,进而根据
计算反应生成的二氧化碳的物质的量,结合反应方程式计算出消耗盐酸的量,计算出两个反应消耗盐酸的总量,进而根据![]() 计算出盐酸的浓度。
计算出盐酸的浓度。
(1)设混合物中含NaHCO3的质量为x;
2NaHCO3==Na2CO3+CO2↑+ H2O质量减少△m
2×84 106 62
x 5.48-4.24
列方程计算出x=2×84×(5.48-4.24)/62=3.36g;ω(NaHCO3)=3.36g/5.48g×100%=61.3%;正确答案:61.3%。
(2)由(1)的计算结果可知:n(NaHCO3)=3.36/84=0.04mol,n(Na2CO3)=(5.48-3.36)/106=0.02mol;根据反应进行计算:根据Na2CO3+HCl== NaCl+NaHCO3可知消耗盐酸0.02 mol;碳酸钠和碳酸氢钠混合物与盐酸反应共产生二氧化碳的量672×10-3/22.4=0.03mol,
根据NaHCO3+HCl== NaCl+CO2↑+H2O反应可知,消耗盐酸的量为0.03 mol,两个反应共消耗盐酸的总量为0.01+0.03=0.04mol, 所用盐酸的物质的量浓度为0.04/0.1=0.4mol·L-1;正确答案:0.4mol·L-1。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
NaCl | MgCl2 | AlCl3 | SiCl4 | CaCl2 | |
熔点/℃ | 801 | 712 | 190 | -68 | 782 |
沸点/℃ | 1 465 | 1 418 | 230 | 57 | 1 600 |
根据这些数据分析,他们认为属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2
B.AlCl3、SiCl4
C.NaCl、CaCl2
D.NaCl、MgCl2、AlCl3、SiCl4、CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A. BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. 常温下,0.1mol/L的HF溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C. KHSO4在熔融状态下可导电:KHSO4=K++H++SO42-
D. 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R2O8n-在一定条件下可以把 Mn2+氧化为 MnO4-,若反应后 R2O8n-变成 RO42-,又知反应中氧化剂与还原剂的物质的量之比为 5:2,则 R2O8n-中 R 元素的化合价为( )
A. +7 B. +6 C. +3 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
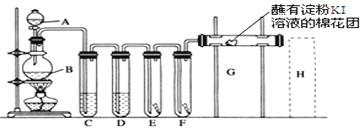
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式___________________。
(2)D中放入浓H2SO4其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论是________________________________。
(4)G处的现象是____________________________________。
(5)用化学方程式写出H处尾气吸收装置中的反应原理____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①消毒液与洁厕灵不能同时使用,原因是(用离子方程式表示)____________。
②需“密闭保存”的原因____________________________________________。
(7)工业上用亚氯酸钠和稀盐酸为原料制备 ClO2 ,写出反应的化学方程式____________。Cl2和ClO2都是强氧化剂,能杀死水中的病菌。等质量的ClO2的氧化能力是Cl2的_______倍。
(8)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,如:[(SCN)2+H2O = HSCN+HSCNO]。它们阴离子的还原性强弱为 Cl-<Br-<CN-<SCN-<I-。试写出:KBr和KSCN的混合溶液中加入(CN)2,反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方式正确的是( )
A. H2气体中含有少量的CO2杂质可以通过灼热的炭粉除去
B. CO2气体中含有的少量HCl杂质可通过饱和Na2CO3溶液除去
C. K2CO3固体中含有少量的NaHCO3杂质可用加热的方式提纯
D. NaOH溶液中含有少量的Ba(OH)2可加入适量的Na2SO4过滤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:

(1)A→B为加成反应,则B的结构简式是______;B→C的反应类型是______.
(2)G中含有的官能团名称是______;F的化学式为______.
(3)D→E的化学方程式是___________________________________________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是________________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为______.
(6)下列说法正确的是______.
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个π键
c.1mol G完全燃烧生成8mol H2O
d.F能发生加成反应、取代反应、氧化反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中一定会产生误差的是
A.在中和热的测定实验中用Ba(OH)2代替NaOH,用H2SO4代替HCl
B.将pH试纸用蒸馏水润湿后测某溶液的pH
C.用碱石灰来干燥氨气
D.使用天平称量时误将药品与砝码的位置放反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com