
【题目】同温同压下,m g甲气体和2m g乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A. 甲与乙的相对分子质量之比为1∶1
B. 同温同压下,甲和乙的密度之比是1∶1
C. 同温同体积下,等质量的甲和乙的压强之比是1∶1
D. 等质量的甲和乙中的原子数之比是1∶1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2xCuCO3。某实验小组设计如下几个实验方案,测定碱式碳酸铜的组成,完成下列填空。
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。
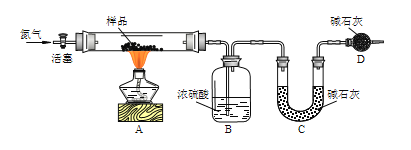
加热完毕再通一段时间氮气的作用是___。
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=___。
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。
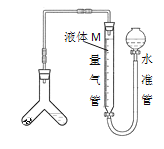
为了减小实验误差,量气管中液体M的选择原则是___。
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是___
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。
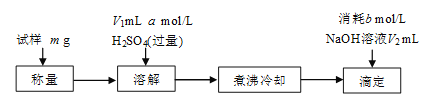
煮沸的目的主要是___。
若滴定时NaOH加入过量,则x值___(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
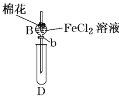
(1)棉花中浸润的溶液为____________,目的是____________________
(2)过程Ⅲ中一定发生反应的离子方程式为________________________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是______________________________________。
(3)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是___________________________。
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.3g Na和2.7g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
A.整个反应过程中共转移电子0.4 mol
B.反应产生的气体在标准状况下的体积是1.12L
C.反应所得溶液与足量CO2反应的离子方程式:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.在稀释、定容操作中用到的全部玻璃仪有:烧杯、玻璃棒、500mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.尼泊金酸与碳酸氢钠反应:![]() +2HCO
+2HCO![]()
![]()
![]() +2CO2
+2CO2![]() +2H2O
+2H2O
B.醋酸溶液与新制氢氧化铜反应:2 H++Cu(OH)2→Cu2++2H2O
C.苯酚钠溶液中通入少量二氧化碳: C6H5O-+CO2 +H2O → C6H5OH+HCO![]()
D.甲醛溶液与足量的银氨溶液共热HCHO+2[Ag(NH3)2]++2OH-![]() CO
CO![]() +2NH
+2NH![]() + 2Ag↓+ 2NH3+ H2O
+ 2Ag↓+ 2NH3+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1。向 2L 密闭容器中通入1mol N2 和 4mol H2,5 分钟达到平衡,此时容器压强为起始时的 0.8,则下列说法正确的是
2NH3(g)ΔH=-92 kJ·mol-1。向 2L 密闭容器中通入1mol N2 和 4mol H2,5 分钟达到平衡,此时容器压强为起始时的 0.8,则下列说法正确的是
A.5min 内,NH3 的平均速率为 0.15 mol/(L·min)
B.H2的转化率为 50%
C.反应放出 92kJ 热量
D.该反应的化学平衡常数表达式为 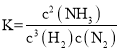
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功发射的“嫦娥”卫星和“玉兔”月球车对探究月球结构和资源开发具有极为重要的战略意义。请回答下列问题:
(1)发射“嫦娥”卫星使用了大功率运载火箭,火箭推进器中装有还原剂肼![]() 和强氧化剂过氧化氢
和强氧化剂过氧化氢![]() ,其反应为
,其反应为 ,已知生成
,已知生成![]() 释放出
释放出![]() 热量。
热量。
①写出![]() 在催化剂作用下分解的化学方程式:_______。
在催化剂作用下分解的化学方程式:_______。
②用电子式表示![]() 的形成过程:_______。
的形成过程:_______。
③若该火箭推进器中![]() 有
有![]() 共价键发生断裂,释放出的热量为_______
共价键发生断裂,释放出的热量为_______![]() 。
。
(2)镍氢蓄电池具有能量密度大、电压高、可多次反复充放电等特性而被用于“玉兔”月球车上,![]() 溶液作电解液,其放电时,正极的电极反应式为
溶液作电解液,其放电时,正极的电极反应式为![]() ,负极的电极反应式为
,负极的电极反应式为 ,利用太阳能充电时负极的电极反应式为
,利用太阳能充电时负极的电极反应式为 。
。
①该镍氢蓄电池放电时的总反应方程式为_______。
②该电池利用太阳能充电时正极的电极反应式为_______。
③该电池工作时,![]() 向_______(填“正极”或“负极”)迁移。
向_______(填“正极”或“负极”)迁移。
④假设电池工作时有![]() 个电子从负极流向正极,则消耗的H2在标准状况下的体积为_______L。
个电子从负极流向正极,则消耗的H2在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶滚中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.下列关于原溶液的说法正确的是
A. 肯定存在NH4+、Cl﹣、Br﹣
B. SO42﹣、SO32﹣至少含有一种
C. 是否存在Na+需要通过焰色反应来确定
D. 肯定不存在Ba2+、Cu2+、SO32﹣、CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com