
【题目】关于如图所示各装置的叙述中,正确的是( )

A. 装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+
B. 装置①中,铁做负极,该电极反应式为:Fe3++e﹣═Fe2+
C. 装置②为铁上镀铜装置c为纯铜电极
D. 若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:TaS2(s)+2I2(g) ![]() TaI4(g)+S2(g)下列说法正确的是
TaI4(g)+S2(g)下列说法正确的是

A. 在不同温度区域,TaI4的量保持不变
B. 在提纯过程中,I2的量不断减少
C. 在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D. 该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中通常含有NO和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化,进而减少汽车尾气对大气的污染。
(1)在100 kPa和298.15 K下,由稳定单质生成1 mol化合物的焓变称为该物质在 298.15 K时的标准摩尔生成焓。已知NO标准摩尔生成焓AH= +91.5 kJ/moI,CO的标准燃烧热AH=- 283kJ/mol,由此写出NO和CO反应的热化学反应方程式____。
(2) 一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应4CO(g)+2NO2(g) = N2(g)+4CO2(g) △H<0,测得相关数据如下:

①5~l0min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则N02的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____(保留两位有效数字)。
(____) N2O4与NO2之间存在反应N2O4(g) ![]() 2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=_____。(Kp为平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=_____。(Kp为平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2除去,如图示,两电极间是固体氧化物电解质,在一定条件下可自由传导 O2-,如果NOx为NO,则电解池阴极电极反应式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法中正确的是( )

A. 固体氧化物的作用是让电子在电池内通过
B. 固体氧化物中O2﹣从a极向b极移动
C. 电极b为电池的负极,电极反应式为:O2+4e﹣=2O2﹣
D. 若以C3H8为燃料气,则接触面上发生的反应为C3H8﹣20e﹣+10O2﹣═3CO2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质碘-13和铯-137。碘-131一旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与铯同主族的前四周期(包括第四周期)的三种元索X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能(kJ·mol-1) | 520 | 496 | 419 |
基态Z原子的核外电子排布式为_______________。X、Y、Z三和元素形成的单质熔点由高到低的顺序为______________(用元素符号表示),其原因为_________________。
(2)F与I同主族,BeF2是由三个原子构成的共价化合物分子,分子中中心原子Be的杂化类型为________________,BeF2分子的空间构型是___________________。
(3)Cl与I同主族,Cl具有很强的活泼性,可以形成很多含氧化合物,其中含氧酸HClO、HClO2、HClO3、HClO4酸性由强到弱的顶序为__________________。
(4)131I2晶体的晶胞结构如图甲所示,该品胞中含有________个131I2分子,该晶体属于______________(填晶体类型)。

(5)KI的晶胞结构如图乙所示,每个K+的配位数为___________。KI晶体的密度为_____ρg·cm-3,K和I的摩尔质量分别为Mk g·mol-1和MI g·mol-1,原子半径分别为rKcm和rIcm,阿伏加德罗常数的值为NA,则KI晶胞中的空间利用率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说祛正确的是
A. 24gMg与足量N2反应生成Mg3N2,转移的电子数为6NA
B. lmolNa218O2中所含的中子数为42NA
C. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
D. 1mol环已烷中含有的共价键数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的验证原电池和电解池的实验装置,下列说法不正确的是.( )

A. 若直流电源 a 为负极,b 为正极,关闭 K2 ,打开 K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒
B. 关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴 入酚酞,发现左侧试管内溶液变红色,则 a 为负极,b 为正极
C. 若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多则a为正极,b为负极
D. 若直流电源 a 为负极,b 为正极,关闭 K2,打开 K1,一段时间后,再关闭 K1,打开 K2,则左 侧石墨棒上发生的电极反应为 H2﹣2e﹣+2OH﹣═2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则

(1)电源A极是____极.
(2)2分钟后,若将乙池恢复到电解前的状态,则应加入______,加入的物质的量为______mol。
(3)丙池中发生反应的离子方程式为:________________
(4)丙装置上某极可析出固体___克,溶液的n(H+)为_____.
(5)电解n分钟后,硫酸铜正好消耗完,再将e、f电极反接电源,用同样的电流再电解n分钟,则丙溶液中的硫酸铜的物质的量浓度为______mol/L.(不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯塑料在生产、生活中有广泛应用,其单体可由乙苯和二氧化碳在一定条件下反应制得,其反应原理如下:
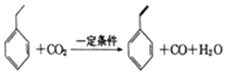
下列有关说法不正确的是
A. 苯乙烯可通过加聚反生成聚苯乙烯
B. 苯乙烯分子中所有原子可能共平面
C. 乙苯、苯乙烯均能使溴水褪色,且其褪色原理相同
D. 等质量的聚苯乙烯与苯乙烯中所含的碳原子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com