
【题目】用NA表示阿伏加德罗常数的数值,下列说祛正确的是
A. 24gMg与足量N2反应生成Mg3N2,转移的电子数为6NA
B. lmolNa218O2中所含的中子数为42NA
C. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
D. 1mol环已烷中含有的共价键数为12NA
科目:高中化学 来源: 题型:
【题目】CO2的大量排放不仅会造成温室效应还会引起海水中富含二氧化碳后酸度增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。所以二氧化碳的吸收和利用成为当前研究的重要课题。
(1)工业上以CO2与H2为原料合成甲醇,再以甲醇为原料来合成甲醚。
已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1
2CH3OH(g)CH3OCH3(g)+H2O(g) △H2=-24.5 kJmol﹣1
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3=-122.5 kJmol﹣1
甲醇的电子式为________________;△H1=________kJ·mol-1
(2)某科研小组探究用活性炭处理汽车尾气的可行性,在T1℃体积为2L的恒温密闭容器中进行了实验,并根据实验数据绘制了如下图像,其中X代表NO浓度变化,Y代表N2和CO2浓度变化:
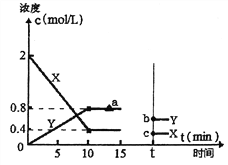
①若15min,后升高到一定温度,达到新平衡后容器中N2、CO2、NO的浓度之比为1:1:3,到达到新平衡时CO2的反应速率与图中a点相比较,速率_____(填“增大”、“减小”或“不变”),此时平衡常数K与T1℃相比_______(填“增大”、“减小”或“不变”)。②T1℃时该反应的平衡常数为_________________。
③如上图所示,若15min后改变了一个条件,t时刻建立新的平衡,b点坐标(0.6,t),c点坐标(0.3,t)。则改变的条件可能是_______(填序号)。
a.扩大容器体积 b.升高温度 c.使用合适催化剂 d.移走部分NO
(3)已知:H2CO3的电离常数Ka1=4.4×10-7,Ka2=5×10-11。25℃时若用1L 1mol· L-1的NaOH溶液吸收CO2,当溶液中c(CO32-):c(H2CO3)=2200,此时该溶液的pH值为________________。
(4)以熔融K2CO3为电解质的甲醚燃料电池,具有能量转化率高,储电量大等特点,则该电池的负极电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的短文,回答问题。
聚碳酸酯(PC)是一类碳酸的聚酯,是一种强韧的热塑性树脂,耐弱酸,耐弱碱,耐中性油,不耐强碱,有阻燃性。其光学性能接近有机玻璃(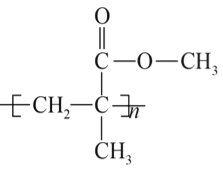 ),在透明建筑板材、电子电器、光盘媒介、汽车工业等领域有广泛应用。碳酸本身并不稳定,但其衍生物,如碳酸二苯酚酯、光气等有一定稳定性。工业上以碳酸的衍生物和双酚A为原料合成聚碳酸酯(PC),反应如下:
),在透明建筑板材、电子电器、光盘媒介、汽车工业等领域有广泛应用。碳酸本身并不稳定,但其衍生物,如碳酸二苯酚酯、光气等有一定稳定性。工业上以碳酸的衍生物和双酚A为原料合成聚碳酸酯(PC),反应如下:
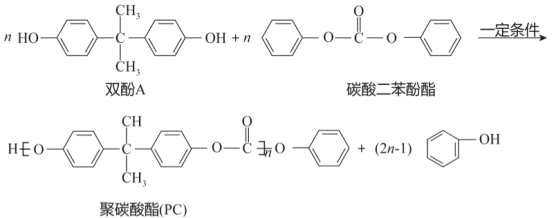
(1)下列说法正确的是_______(填序号)。
a.光气比碳酸稳定
b.聚碳酸酯能和强碱发生反应
c.聚碳酸酯易燃
d.聚碳酸酯是一种强韧的热塑性树脂
(2)双酚A和光气(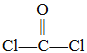 )也可发生类似的缩聚反应,生成一种聚碳酸酯。该反应的化学方程式是___________________________________________________。
)也可发生类似的缩聚反应,生成一种聚碳酸酯。该反应的化学方程式是___________________________________________________。
(3)有机玻璃的单体的结构简式是___________________________________________。在一定条件下,有机玻璃和NaOH溶液能发生反应,该反应的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法合理的是( )
A. Si可用于制造太阳能电池
B. 液氨可用作制冷剂
C. 聚氯乙烯可用于制食品包装袋
D. 漂白粉可用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品—3PbO·PbSO4·H2O (三盐),主要制备流程如下:
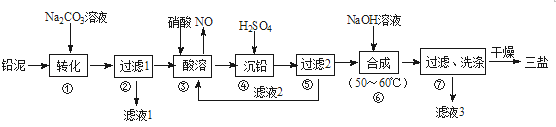
(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为______________。
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为_________(写化学式)。
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为_______;滤液2中溶质主要成分为________(写化学式)。
(4)步骤⑥合成三盐的化学方程式为___________。
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=![]() ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。

①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50 mL 0.50mol·L-l盐酸与50 mL 0.55 mol·L-1NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量并计算中和热,回答下列问题:
(1)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:
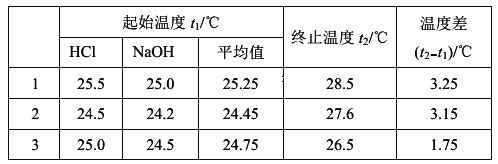
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4. 2×10-3kJ/(g·℃),则该反应的中和热△H=__________。
(2)若用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会____(填“偏小”、“偏大”或“不变”),其原因是___________________________________。
(3)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_____________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有甲、乙两份体积均为1L、浓度均为0.1mol·L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释到100L时,溶液的pH变为x;②乙与等体积、浓度为0.2mol·L-1的NaOH溶液混合,在混合液中:n(CH3COO-)+n(OH-)-(H+)=y mol。x、y的正确答案组合为
A. 3<x<5、0.2 B. 3<x<5、0.1 C. 3、0.1 D. 5、0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)可用于医药及香料的合成,A有如下转化关系:

已知信息:
①A不能使酸性高锰酸钾溶液褪色;
② ;
;
③![]()
回答下列向题:
(1)B→D与H→I的反应类型分别为:_________、_________。
(2)K所含官能闭的名称为___________,B的结构简式为____________。
(3)由E生成F的反应方程式为___________________________。
(4)J为一种具有3个六元环的酯,则其结构简式为_________________。
(5)F的同分异构体中,能与NaHCO3反应生成CO2,且核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的结构有_________种。
(6)糖叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁基氯[(CH3)3CCl]和糠醛(  )为原料制备糖叉丙酮的合成路线(无机试剂任用) _______。合成流程图示例如下:
)为原料制备糖叉丙酮的合成路线(无机试剂任用) _______。合成流程图示例如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com