
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=![]() ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。

①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
【答案】-175kJ/mola12g4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJ·mol-1H2-2e-+2OH- =2H2O34.3CH3COO--8e-+2H2O=2CO2↑+7H+NH4+在好氧微生物反应器中转化为NO3-,NO3-在MFC电池正极转化为N23CO2+4Na++4e-=2Na2CO3+C15.8
【解析】
(1)①拆开3mol H2 (g)和1mol CO2(g)中化学键所吸收的总能量为3×436 KJ+2×745 KJ=2798 KJ,形成1mol CH3OH(g) 和1mol H2O(g)所放出的能量是3×412 KJ+351 KJ+3×462 KJ=2973 KJ,所以该反应的焓变为2798 KJ/mol -2973 KJ/mol =-175 KJ/mol;
②根据电子流动方向为由c电极流向d电极,则c电极电子流出,作负极,发生氧化反应,故a口输入甲醇,电极反应为:H2O+CH3OH-6e-=CO2+6H+,通入的甲醇以及生成二氧化碳都不影响溶液质量,转移6mol电子时,消耗了1mol H2O ,生成了6 mol H+,减小的质量m=18g-6g=12g,当转移1mol电子时,左侧质量减轻2g,还有1 mol H+通过质子交换膜进入右侧,质量减少1g; d电极电子流入,作正极,发生还原反应,故b口进入氧气,电极反应为:4H++ O2+ 4e-=2 H2O,转移4mol电子时,1mol O2生成2mol H2O ,增加的质量为消耗氧气的质量m=32g,当转移1mol电子时,右侧质量增加8g,加上转移过来的氢离子1g,因此左右两侧溶液的质量之差为:8g+1g+2g+1g=12g。
(2)①
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ·mol-1
②H2O(g)= H2O(l) △H2=-44kJ·mol-1
③H2(g) +1/2O2(g) =H2O(l) △H3=-285.8kJ·mol-1
④4H2(g) +2NO2(g) =4H2O(g) +N2(g) △H
由盖斯定律得:④=4×③-4×②-①,所以△H=4×△H3-4×△H2-△H1=-1100.2kJ·mol-1
综上所述,4H2(g) +2NO2(g) =4H2O(g) +N2(g) △H=-1100.2kJ·mol-1;
②氢氧燃料电池中,负极失去电子,发生氧化反应,所以氢气作负极,因为电解质为氢氧化钠,所以电极反应为:H2-2e-+2OH- =2H2O;根据公式:比能量=![]() ,1mol氢气参加反应,放出的热量为285.8kJ,因为该电池的能量转换效率为86.4%,所以输出电能为285800J×86.4%/(3.6×106 J) ×1 kW·h =6.8×10-3 kW·h,1mol氢气的质量为2×10-3Kg,所以比能量=6.8×10-3 kW·h÷2×10-3Kg=3.4_kW·h·kg-1;
,1mol氢气参加反应,放出的热量为285.8kJ,因为该电池的能量转换效率为86.4%,所以输出电能为285800J×86.4%/(3.6×106 J) ×1 kW·h =6.8×10-3 kW·h,1mol氢气的质量为2×10-3Kg,所以比能量=6.8×10-3 kW·h÷2×10-3Kg=3.4_kW·h·kg-1;
(3)①原电池中A电极作负极,醋酸根被氧化为二氧化碳,所以电极反应为:CH3COO--8e-+2H2O=2CO2↑+7H+;B电极作正极,得到电子,硝酸根被还原为氮气;
②NH4+在好氧微生物反应器中转化为NO3-,NO3-在MFC电池正极转化为N2,从而除去NH4+;
(4)①正极CO2的电子发生还原反应,故电极方程式为:3CO2+4Na++4e-=2Na2CO3+C;
②正极发生电极反应为:3CO2+4Na++4e-=2 Na2CO3+C,每转移0.2 mol e-,则有0.1 mol Na2CO3和0.05 mol C生成,则正极质量增加m=106g/mol×0.1 mol+12 g/mol×0.05 mol=11.2g;负极发生电极反应为:4Na-4e-=4Na+,每转移0.2 mol e-,则有0.2 mol Na被消耗,所以正极质量减小m=23 g/mol×0.2 mol=4.6g,故两极的质量差为11.2g+4.6g=15.8g。


科目:高中化学 来源: 题型:
【题目】金属镍与铁,钴相似,在常温下对水和空气都较稳定,能抗碱性腐蚀。常温下,镍即可与一氧化碳反应,形成剧毒的四羰基镍(Ni(CO)4),加热后它又会分解成金属镍和—氧化碳。工业上用含废镍废料(含有铝、铁和有机物)为原料制备兰尼镍的工艺流程如图所示:
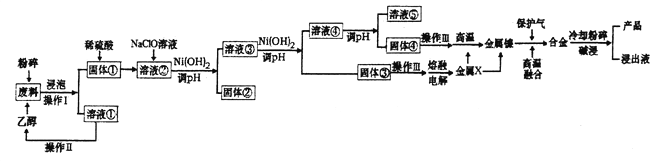
已知:25℃时Ni(OH)2的Ksp=5.4×10-16;Al(OH)3的Ksp=3.0×10-34.
(1)若将NaOH固体进行高温熔融,可选择的坩埚为_________。
a.铁坩埚 b.氧化铝坩埚 c.石英坩埚 d.镍坩埚
(2)操作Ⅱ的名称为__________;实验室中在进行操作III时,仪器除酒精灯、坩埚、三脚架外还缺______________。
(3)加入NaC1O溶液时发生反应的离子反应方程式______________________________。
(4)固体④经操作III得到NiO。合金中铝和镍的物质的量之比为2:3,则前后两份金属铝用量的最佳配比为________________。
(5)25℃时,若测得溶液⑤pH=9,该溶液中c(Ni2+)/c(A13+)=__________。
(6)将金属X与金属镍进行高温融合时,可否用CO做保护气,请说明原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列6种符号回答问题:①1H ②2H ③3H ④14C ⑤14N ⑥16O
(1)共有_______种核素,属于_______种元素。
(2)互为同位素的是____________。(填序号,下同)
(3)质量数相等的是______________,中子数相等的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说祛正确的是
A. 24gMg与足量N2反应生成Mg3N2,转移的电子数为6NA
B. lmolNa218O2中所含的中子数为42NA
C. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
D. 1mol环已烷中含有的共价键数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
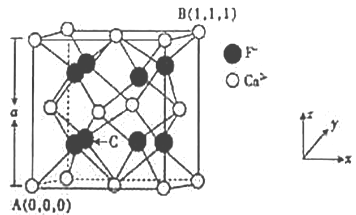
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com