
【题目】CO2的大量排放不仅会造成温室效应还会引起海水中富含二氧化碳后酸度增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。所以二氧化碳的吸收和利用成为当前研究的重要课题。
(1)工业上以CO2与H2为原料合成甲醇,再以甲醇为原料来合成甲醚。
已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1
2CH3OH(g)CH3OCH3(g)+H2O(g) △H2=-24.5 kJmol﹣1
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3=-122.5 kJmol﹣1
甲醇的电子式为________________;△H1=________kJ·mol-1
(2)某科研小组探究用活性炭处理汽车尾气的可行性,在T1℃体积为2L的恒温密闭容器中进行了实验,并根据实验数据绘制了如下图像,其中X代表NO浓度变化,Y代表N2和CO2浓度变化:
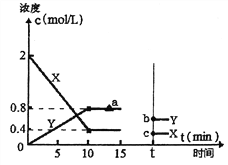
①若15min,后升高到一定温度,达到新平衡后容器中N2、CO2、NO的浓度之比为1:1:3,到达到新平衡时CO2的反应速率与图中a点相比较,速率_____(填“增大”、“减小”或“不变”),此时平衡常数K与T1℃相比_______(填“增大”、“减小”或“不变”)。②T1℃时该反应的平衡常数为_________________。
③如上图所示,若15min后改变了一个条件,t时刻建立新的平衡,b点坐标(0.6,t),c点坐标(0.3,t)。则改变的条件可能是_______(填序号)。
a.扩大容器体积 b.升高温度 c.使用合适催化剂 d.移走部分NO
(3)已知:H2CO3的电离常数Ka1=4.4×10-7,Ka2=5×10-11。25℃时若用1L 1mol· L-1的NaOH溶液吸收CO2,当溶液中c(CO32-):c(H2CO3)=2200,此时该溶液的pH值为________________。
(4)以熔融K2CO3为电解质的甲醚燃料电池,具有能量转化率高,储电量大等特点,则该电池的负极电极反应式为______________________。
【答案】 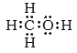 -49 增大 减小 4 ad 10 CH3OCH3-12e-+6CO32-=8CO2+3H2O
-49 增大 减小 4 ad 10 CH3OCH3-12e-+6CO32-=8CO2+3H2O
【解析】(1)甲醇的结构简式为CH3OH,电子式为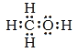 ;已知:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1,②2CH3OH(g)CH3OCH3(g)+H2O(g)△H=-24.5kJmol-1,③3CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=-122.5kJmol-1,根据盖斯定律,③-②得3CO2(g)+6H2(g)2CH3OH(g)+2H2O(g)△H=-98kJmol-1,则CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-49kJmol-1,故答案为:
;已知:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1,②2CH3OH(g)CH3OCH3(g)+H2O(g)△H=-24.5kJmol-1,③3CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=-122.5kJmol-1,根据盖斯定律,③-②得3CO2(g)+6H2(g)2CH3OH(g)+2H2O(g)△H=-98kJmol-1,则CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-49kJmol-1,故答案为: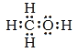 ;-49;
;-49;
(2)①反应的方程式为2NO+C![]() N2+CO2,
N2+CO2,
起始(mol/L) 2 0 0
反应(mol/L) 1.6 0.8 0.8
平衡(mol/L) 0.4 0.8 0.8
平衡时N2、CO2、NO的浓度之比为1:1:2,升高到一定温度,反应速率增大,达到新平衡后容器中N2、CO2、NO的浓度之比为1:1:3,则升高温度,平衡逆向移动,正反应为放热反应,平衡常数减小,故答案为:增大;减小;
②根据上述分析,T1℃时该反应的平衡常数=![]() =4,故答案为:4;
=4,故答案为:4;
③根据图示,若15min后改变了一个条件,t时刻建立新的平衡,b点坐标(0.6,t),c点坐标(0.3,t)。X、Y的浓度均减小,均变成原来的![]() 。a.扩大容器体积,平衡不移动,但浓度减小,正确;b.升高温度,平衡一定移动,浓度变化幅度不可能相等,错误;c.使用合适催化剂,反应速率加快,平衡不移动,浓度不变,错误;d.移走部分NO,平衡不移动,相当于扩大容器体积,浓度减小,正确;故选ad;
。a.扩大容器体积,平衡不移动,但浓度减小,正确;b.升高温度,平衡一定移动,浓度变化幅度不可能相等,错误;c.使用合适催化剂,反应速率加快,平衡不移动,浓度不变,错误;d.移走部分NO,平衡不移动,相当于扩大容器体积,浓度减小,正确;故选ad;
(3) 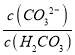 =
=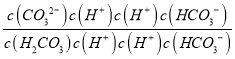 =
=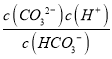 ×
×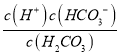 ×
×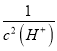 = Ka2×Ka1×
= Ka2×Ka1×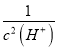 =5×10-11×4.4×10-7×
=5×10-11×4.4×10-7×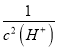 =2200,解得c(H+)=10-10 mol/L,pH=10,故答案为:10;
=2200,解得c(H+)=10-10 mol/L,pH=10,故答案为:10;
(4)以熔融K2CO3为电解质的甲醚燃料电池中甲醚在负极发生氧化反应生成二氧化碳,电极反应式为CH3OCH3-12e-+6CO32-=8CO2+


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某衣服面料成分:棉72%、聚酯纤维28%,下列说法正确的是
A. 棉花的主要成分为纤维素
B. 聚酯纤维属于天然纤维
C. 洗涤该衣服不适合用加酶洗涤剂
D. 该衣服的两种成分均属于合成材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质变化的比较,不正确的是( )
A.还原性强弱:F﹣>Cl﹣>I﹣
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.稳定性强弱:HF>HCl>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g) +2B(g)![]() C(p)。反应过程中测定的部分数据见下表:
C(p)。反应过程中测定的部分数据见下表:
反应时间/min | n(A)/mol | n(B)/ mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
下列说法错误的是
A. 前10min内反应的平均速率为v(C)=0.0250 mnol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60mo1B气体,到达平衡时,n(C)<0.25mo1
C. 其他条件不变时,向平衡体系中再充入0.50molA,与原平衡相比,达平衡时B的转化率增大,A的体积分数增大
D. 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇可由乙烯气相直接水合法或间接水合法生产,一些转化如图。

某些物质的有关数据如下表:
熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | -114.1 | 78.3 | 易溶 |
乙醛 | -121 | 20.8 | 易溶 |
乙酸乙酯 | -83 | 77.0 | 难溶 |
回答以下问题:
(1)间接水合法中的转化③:乙烯与浓硫酸反应生成硫酸氢乙酯(CH3CH2—OSO3H)的有机反应类型是_____________,转化④的化学方程式是__________________;
(2)蘸有B的玻璃棒遇到氮的最简单氢化物气体会冒白烟,反应的化学方程式为________,转化⑤的化学方程式为______________________________;
(3)将一质量为w的铜丝灼烧变黑后,迅速插入乙醇中,变黑的铜丝恢复红色。
①使铜丝恢复红色的反应的化学方程式为________________________;
②若要证明铜丝起催化作用,还需要进行的操作是_______________;
(4)已知:CH3CHO + NaHSO3 →![]() ↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
![]()
①α-羟基乙磺酸钠的晶体类型为___________________。
②分离操作A的名称是________________;
③某同学设计分离操作B的装置(夹持和加热装置已略去)如图所示。冷凝管中的液体应从_____口进。(填“D”或“E”)

下列有关操作与装置的分析,正确的是_____。(填字母,多选反扣)
A.烧杯中应装冰水
B.冷凝管应通温水
C.图示装置可用于除去乙酸乙酯中混有的乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍与铁,钴相似,在常温下对水和空气都较稳定,能抗碱性腐蚀。常温下,镍即可与一氧化碳反应,形成剧毒的四羰基镍(Ni(CO)4),加热后它又会分解成金属镍和—氧化碳。工业上用含废镍废料(含有铝、铁和有机物)为原料制备兰尼镍的工艺流程如图所示:
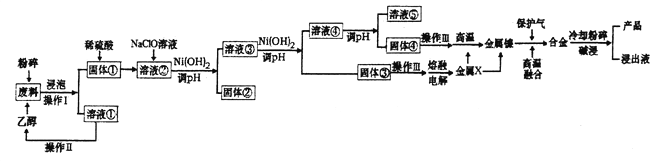
已知:25℃时Ni(OH)2的Ksp=5.4×10-16;Al(OH)3的Ksp=3.0×10-34.
(1)若将NaOH固体进行高温熔融,可选择的坩埚为_________。
a.铁坩埚 b.氧化铝坩埚 c.石英坩埚 d.镍坩埚
(2)操作Ⅱ的名称为__________;实验室中在进行操作III时,仪器除酒精灯、坩埚、三脚架外还缺______________。
(3)加入NaC1O溶液时发生反应的离子反应方程式______________________________。
(4)固体④经操作III得到NiO。合金中铝和镍的物质的量之比为2:3,则前后两份金属铝用量的最佳配比为________________。
(5)25℃时,若测得溶液⑤pH=9,该溶液中c(Ni2+)/c(A13+)=__________。
(6)将金属X与金属镍进行高温融合时,可否用CO做保护气,请说明原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. a—定由W、X两种元素组成
D. 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NO和NO2的叙述正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的物质的量相等
D.NO2可用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说祛正确的是
A. 24gMg与足量N2反应生成Mg3N2,转移的电子数为6NA
B. lmolNa218O2中所含的中子数为42NA
C. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
D. 1mol环已烷中含有的共价键数为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com