
【题目】常温下,有甲、乙两份体积均为1L、浓度均为0.1mol·L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释到100L时,溶液的pH变为x;②乙与等体积、浓度为0.2mol·L-1的NaOH溶液混合,在混合液中:n(CH3COO-)+n(OH-)-(H+)=y mol。x、y的正确答案组合为
A. 3<x<5、0.2 B. 3<x<5、0.1 C. 3、0.1 D. 5、0.2
科目:高中化学 来源: 题型:
【题目】下列关于NO和NO2的叙述正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的物质的量相等
D.NO2可用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说祛正确的是
A. 24gMg与足量N2反应生成Mg3N2,转移的电子数为6NA
B. lmolNa218O2中所含的中子数为42NA
C. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
D. 1mol环已烷中含有的共价键数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
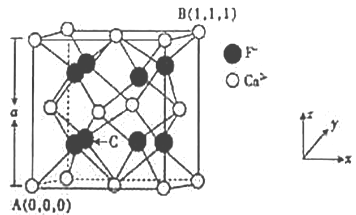
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中进行可逆反应2NO2![]() 2NO+O2,下列能作为反应达到平衡状态标志的是( )
2NO+O2,下列能作为反应达到平衡状态标志的是( )
①单位时间内生成nmol O2的同时生成2n mol NO2
②单位时间内生成n mol O2 的同时生成2n mol NO
③用NO2 、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变 ⑤混合气体的密度不再改变
⑥混合气体的压强不再改变 ⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H3AsO4溶液中各含砷粒子分布分数(平衡时该粒子的浓度与各含砷粒子浓度之和的比)与pH的关系如右图所示。下列说法正确的是
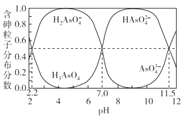
A. H3AsO4的第一步电离常数Ka1>0.01
B. pH=7.0时.溶液中c(AsO43-)=c(H3AsO4)=0
C. 0.1mol·L-1H3AsO4溶液的pH<2
D. pH=12时,c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
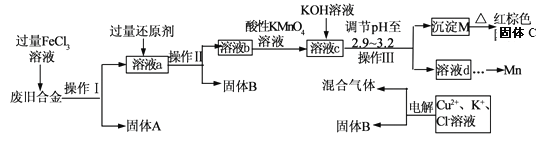
已知:298K时,Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cu(OH)2]=2.2×10一20,
Ksp[Mn(OH)2]=1.9×10—13
回答下列问题:
(1)操作I、Ⅱ、Ⅲ为________,固体B为_________ (填化学式)。
(2)加人过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式__________________。
(3)调节pH至2.9~3.2的目的是分离_________ (填离子符号)
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_________________。
②若用 a mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液V mL,所得红棕色固体C的物质的量为_________(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为_________ (填化学式)。
(6)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,则生成氧气的物质的量为________ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl = NaCl + H2O, B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A.__________B.____________。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是_________(填“锌”或“铜”);
②正极的电极反应式为__________________________________;
③产生这些气体共需转移电子_________________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com