
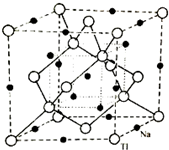
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.| m |
| V |
| 1 |
| 2 |
| 6+0 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 4 | ||
|
| m |
| V |
| ||||
(
|
681
| ||
| 8×10-30a3NA |
681
| ||
| 8×10-30a3NA |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、Be2+中的质子和电子 | ||
B、
| ||
| C、NaHCO3中的阳离子和阴离子 | ||
| D、Na2O2中的阴离子和阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸和水能任意比例混溶 |
| B、乙酸水溶液能使紫色石蕊试液变红色 |
| C、醋酸能与碳酸钠溶液反应生成CO2气体 |
| D、在25℃时,1mol/L的CH3COONa溶液的pH约为9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com