
 2PbSO4+2H2O,由此可知,该电池放电时的负极是
2PbSO4+2H2O,由此可知,该电池放电时的负极是| A.PbO2 | B.Pb | C.H2SO4 | D.PbSO4 |
科目:高中化学 来源:不详 题型:填空题
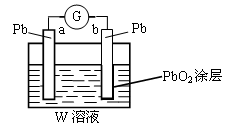
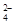 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.电子由铜片通过导线流向锌片 |
| B.烧杯中溶液逐渐呈蓝色 |
| C.锌片逐渐溶解 |
| D.该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原电池是将电能转化为化学能的装置 |
| B.在原电池中,负极上发生氧化反应 |
| C.在原电池中,电子从原电池的正极流向负极 |
| D.由于生铁中含有碳,所以生铁比纯铁耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.负极发生还原反应 |
B.正极反应为 Cu - 2e- Cu2+ Cu2+ |
| C.电子由锌片通过导线流向铜片 |
| D.该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正极发生还原反应 | B.正极与负极上参加反应的气体的物质的量之比为2∶9 |
| C.通乙烷的电极为负极 | D.电池工作过程中,溶液的pH逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com