
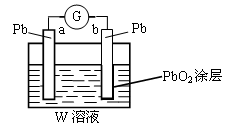
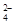 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
 (1分)
(1分)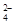 = PbSO4(2分) 5.07 mol/L (1分)
= PbSO4(2分) 5.07 mol/L (1分) 。
。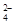 = PbSO4,所以总反应式是PbO2+Pb+2H2SO4=2PbSO4+2H2O。因此当a极消耗0.05 mol Pb时,消耗硫酸是0.1mol。反应前硫酸的物质的量是1000g×1.3g/ml×39%÷98g/mol=5.17mol,所以反应后剩余硫酸是5.07mol,则其浓度是5.07mol/L。
= PbSO4,所以总反应式是PbO2+Pb+2H2SO4=2PbSO4+2H2O。因此当a极消耗0.05 mol Pb时,消耗硫酸是0.1mol。反应前硫酸的物质的量是1000g×1.3g/ml×39%÷98g/mol=5.17mol,所以反应后剩余硫酸是5.07mol,则其浓度是5.07mol/L。

科目:高中化学 来源:不详 题型:单选题

| A.烧杯a中的溶液pH升高 | B.锌是化学电源的正极 |
| C.烧杯a中发生的反应为2H++2e-=H2↑ | D.盐桥中的阳离子向铁电极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 正极 | Zn | Cu | Zn | Fe |
| 负极 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳棒上有气体放出,溶液酸性变弱 | B.a是负极,b是正极 |
| C.导线中有电子流动,电子从a极到b极 | D.a极上发生了还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.盐桥中的阴离子向硫酸铜溶液中迁移 |
| B.锌电极发生还原反应,铜电极发生氧化反应 |
| C.铜电极上发生的电极反应是2H++e— →H2↑ |
| D.电子从锌电极通过检流计流向铜电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极反应为O2+2H2O+4e-===4OH- |
| B.电池工作时,正极区pH升高 |
| C.电池工作时溶液中的阴离子移向正极 |
| D.电池的总反应为:2H2+O2===2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2PbSO4+2H2O,由此可知,该电池放电时的负极是
2PbSO4+2H2O,由此可知,该电池放电时的负极是| A.PbO2 | B.Pb | C.H2SO4 | D.PbSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com