

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
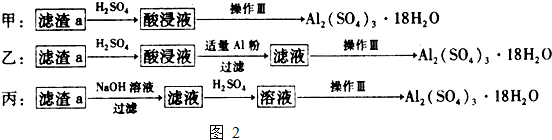
| 15b |
| a |
| 15b |
| a |


科目:高中化学 来源: 题型:
| A、为增大泡沫灭火器中Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物 |
| B、为加快盐酸和锌制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液 |
| C、在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠 |
| D、用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用6 mL乙醇、4 mL浓H2SO4、4 mL冰醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
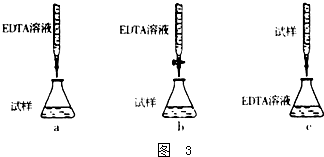
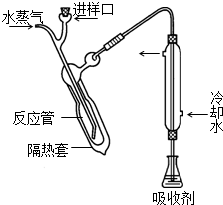 凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
凯氏定氮法测定奶粉中蛋白质含量的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:

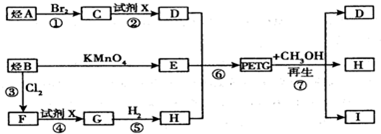 这种材料可采用如图所示的合成路线已知:(1)
这种材料可采用如图所示的合成路线已知:(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
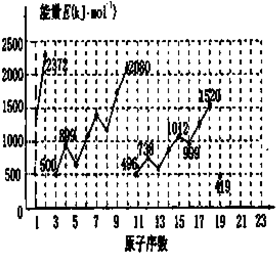 原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com